元素化合物易错点总结归纳
时间:2021-03-16 08:52 来源:未知 作者:化学自习室 点击: 次 所属专题: 易错点 元素化合物
版权申明:凡是署名为“化学自习室”,意味着未能联系到原作者,请原作者看到后与我联系(邮箱:79248376@qq.com)!
一、钠及其化合物的注意防范
(1)金属钠与可溶性盐溶液反应的一种思维模式
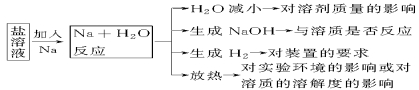
(2)钠的性质的2点注意
①Na及其化合物发生焰色反应时火焰颜色均为黄色,且该变化为物理变化。鉴别Na、K利用焰色反应,二者混合时鉴别K元素要隔着蓝色钴玻璃。
②无论Na与O2反应生成Na2O还是Na2O2,只要参与反应的Na的质量相等,则转移电子的物质的量一定相等。
(3)过氧化钠结构与性质的4点防范:①Na2O2的电子式为Na+[·······]2-Na+,阴阳离子个数比为1∶2。
②1 mol Na2O2与足量水或二氧化碳的反应中转移的电子数为NA。
③Na2O2具有强氧化性,能氧化破坏有机色素的分子结构,具有漂白性。
④Na2O2与SO2反应的化学方程式为Na2O2+SO2===Na2SO4。
二、镁及其化合物
(1)镁在空气中燃烧主要反应:2Mg+O2 2MgO,还发生:3Mg+N2
2MgO,还发生:3Mg+N2 Mg3N2、2Mg+CO2
Mg3N2、2Mg+CO2 2MgO+C。
2MgO+C。
(2)Mg3N2与水反应:Mg3N2+6H2O===3Mg(OH)2+2NH3↑。
(3)加热Mg(HCO3)2溶液生成的是Mg(OH)2沉淀,而不是MgCO3沉淀,因为Mg(OH)2比MgCO3更难溶于水。反应方程式为Mg(HCO3)2 MgCO3↓+CO2↑+H2O MgCO3+H2O
MgCO3↓+CO2↑+H2O MgCO3+H2O Mg(OH)2+CO2↑。
Mg(OH)2+CO2↑。
三、铝及其化合物的“盲点”
(1)钝化的一个误区: 很多考生误认为Fe、Al在常温下遇到浓硫酸、浓硝酸不反应,其实发生了氧化还原反应,只是在金属表面生成了一层致密的氧化物薄膜,阻止了反应的进一步发生,这就是钝化。所以虽然铝是活泼金属,但是抗腐蚀性相当强。如果加热,反应继续进行。
(2)铝热反应的三个要点
(1)中学化学中唯一一类金属单质与金属氧化物在高温条件下的置换反应。
(2)铝热剂是单质铝与难熔金属氧化物的反应,并不是Al与所有金属氧化物均能组成铝热剂,该金属氧化物对应的金属活泼性应比铝弱。
(3)引发铝热反应的操作是高考实验考查的热点,操作是先铺一层KClO3,然后插上镁条,最后点燃镁条引发反应。
(3)铝三角转化的应用
①判断离子共存:Al3+与OH-、S2-、HS-、AlO2-、CO32-、HCO3-因为相互促进水解或生成沉淀而不能大量共存,AlO2-与H+、NH4+、Al3+、Fe3+等不能大量共存。
②物质的鉴别(利用滴加顺序不同,现象不同):AlCl3溶液中滴加NaOH溶液现象为:先生成白色沉淀,后沉淀溶解;NaOH溶液中滴加AlCl3溶液现象为:开始生成沉淀立即溶解,后产生白色沉淀,继续滴加沉淀不溶解。
③Al(OH)3的制备:
A.可溶性铝盐和氨水反应:Al3++3NH3·H2O===Al(OH)3↓+3NH4+。
B.可溶性铝盐和偏铝酸盐反应:Al3++3AlO2-+6H2O===4Al(OH)3↓。
C.偏铝酸盐和弱酸反应:AlO2-+CO2+2H2O===Al(OH)3↓+HCO3-。
四、铁及其化合物的“特殊性”
(1)Fe与Cl2反应只能生成FeCl3,与I2反应生成FeI2,与反应物的用量无关。
(2)Fe与水蒸气在高温下反应生成H2和Fe3O4,而不是Fe2O3。
(3)过量的Fe与硝酸作用,或在Fe和Fe2O3的混合物中加入盐酸,均生成Fe2+。要注意产生的Fe3+还可以氧化单质Fe这一隐含反应:Fe+2Fe3+===3Fe2+。(4)NO3与Fe2+在酸性条件下不能共存。
(5)Fe2O3、Fe(OH)3与氢碘酸反应时,涉及Fe3+与I-的氧化还原反应,产物为Fe2+、I2和H2O。
(6)FeCl3溶液加热浓缩时,因Fe3+水解和HCl的挥发,得到的固体为Fe(OH)3,灼烧后得到红棕色Fe2O3固体;而Fe2(SO4)3溶液蒸干时,因硫酸是难挥发性的酸,将得不到Fe(OH)3固体,最后得到的固体仍为Fe2(SO4)3。
(7)注意亚铁盐及Fe(OH)2易被空气中氧气氧化成三价铁的化合物。如某溶液中加入碱溶液后,最终得到红褐色沉淀,并不能断定该溶液中一定含有Fe3+,也可能含有Fe2+。
五、铁盐、亚铁盐水解原理的四大应用
(1)Fe3+必须在酸性条件下才能大量存在,当pH=7时,Fe3+几乎完全水解生成Fe(OH)3沉淀。因此配制FeCl3溶液要加入浓盐酸防止水解。
(2)除去酸性溶液ZnCl2中的FeCl2,先通入Cl2或加H2O2,使Fe2+转化为Fe3+再加ZnO,使Fe3+水解生成沉淀过滤除去。
(3)配制FeCl2溶液既要防氧化(加入Fe粉),又要防水解(加入盐酸)。
(4)高铁酸钠(Na2FeO4)可以净水的原因有两点:一是Fe处于最高价,高铁酸钠具有强氧化性,可以杀菌消毒,二是高铁酸钠被还原为Fe3+,水解后生成的氢氧化铁胶体可以吸附水中的悬浮物而净水。
六、铜及其化合物常考点
(1)铜的存在。常见的铜矿有黄铜矿(主要成分为CuFeS2)、孔雀石[主要成分为CuCO3·Cu(OH)2]等。此外铁在自然界中还以游离态的形式存在于陨铁中。自然界中也存在少量的单质铜。
(2)熟记六种颜色
| Cu | CuO | Cu2S | CuS | Cu2O | 铜的焰色反应 |
紫红色 | 黑色 | 黑色 | 黑色 | 砖红色 | 绿色 |
(3)制备与精炼。工业上主要采用高温冶炼黄铜矿(主要成分是CuFeS2)的方法获得铜。用这种方法冶炼得到的铜,含铜量为99.5%~99.7%,还含有Ag、Au、Fe、Zn等杂质。要达到电气工业生产用铜的要求,这种由黄铜矿高温冶炼得到的铜还必须经过电解精炼,电解精炼得到的铜,含铜量高达99.95%~99.98%。
(4)Cu和一定量的浓HNO3反应,产生的是NO2和NO的混合气体,当Cu有剩余,再加入稀H2SO4,Cu继续溶解。
七、金属冶炼的方法与四点注意
金属冶炼的方法与金属活动性顺序表有密切的关系:
K Ca Na Mg Al | Zn Fe Sn Pb(H) Cu | Hg Ag | Pt Au |
电解法 | 热还原法 | 加热分解法 | 物理方法 |
(1)热还原法中使用的还原剂为碳、一氧化碳和氢气,在高炉炼铁中,加入的还原剂是焦炭,但真正作还原剂是CO。
(2)电解法冶炼活泼金属使用的是熔融的金属盐或金属氧化物,不是盐溶液。钠、镁、铝的冶炼是电解熔融的NaCl、MgCl2、Al2O3;不用氧化镁是因为其熔点高,不用氯化铝是因为AlCl3是共价化合物,熔融态不导电。
(3)在金属活动性顺序表中,虽然前面的金属能够将后面的金属从其化合物中置换出来,但不一定是从其盐溶液中置换,例如Na由于活泼性太强,不能从CuCl2溶液中置换出Cu,但是可以在熔融状态下置换出铜。
(4)冶炼铜的三种方法:热还原法;湿法炼铜;电解精炼铜。
八、非金属化合物的“三大酸性规律”
(1)最高价氧化物对应水化物的酸性强弱取决于元素非金属性的强弱。如非金属性:Cl>S>P>C>Si,则最高价氧化物对应水化物的酸性:HClO4>H2SO4>H3PO4>H2CO3>H2SiO3。
(2)利用复分解反应中“强酸制弱酸”的规律判断酸性强弱顺序,如:
Na2SiO3+CO2+H2O===Na2CO3+H2SiO3↓,则酸性H2CO3>H2SiO3;
NaClO+CO2+H2O===NaHCO3+HClO,则酸性H2CO3>HClO。
(3)酸的氧化性与还原性:
①氧化性酸:HNO3、浓H2SO4、HClO等,其发生氧化还原反应时,中心原子被还原,其还原产物为:HNO3→NO2或NO(N2、N2O、NH4+等)、H2SO4(浓)→SO2、HClO→Cl-(或Cl2)。
②还原性酸:H2SO3、H2S、HI、HBr、HCl
九、氯及其化合物注意点
1、氯气易错点提醒
(1)1 mol Cl2参加反应,转移电子数不一定为2NA。如反应Cl2+2NaOH===NaCl+NaClO+H2O,
1 mol Cl2参加反应,转移电子数目为NA。
(2)氯气作为氧化剂使用,如将Fe2+氧化为Fe3+。
(3)实验室制Cl2,除了用MnO2和浓盐酸反应外,还可以用KMnO4、KClO3、NaClO与浓盐酸反应且都不需要加热,因此酸性KMnO4溶液用的是H2SO4酸化而不是盐酸。
2、次氯酸盐的两大性质及应用
(1)ClO-不论在酸性环境中还是在碱性环境中均能体现强氧化性,如ClO-与SO32-、I-、Fe2+均不能大量共存;向Ca(ClO)2溶液中通入SO2气体生成CaSO4而不是CaSO3,其离子方程式为
Ca2++3ClO-+SO2+H2O===CaSO4↓+Cl-+2HClO(少量SO2);
Ca2++2ClO-+2SO2+2H2O===CaSO4↓+2Cl-+SO42-+4H+(过量SO2)。
(2)ClO-体现水解性,因HClO酸性很弱,ClO-水解显碱性,如Fe3++3ClO-+3H2O===Fe(OH)3↓+3HClO,所以ClO-与Fe3+、Al3+均不能大量共存。
十、硅及其化合物的五大特性与用途
(1)工业上制备粗硅,是用过量的C和SiO2高温下反应,由于C过量,生成的是CO而不是CO2。
(2)SiO2不导电,是制作光导纤维的材料;Si是半导体,是制作光电池的材料。
(3)SiO2是酸性氧化物,酸性氧化物一般能与水反应生成酸,但SiO2不溶于水;酸性氧化物一般不与酸作用,但SiO2能与HF反应,不过SiO2不属于两性氧化物,因为该反应生成的不是盐和水。
(4)硅酸盐大多难溶于水,但硅酸钠水溶液称为泡花碱或水玻璃,却是盐溶液且属一种矿物胶。NaOH溶液或纯碱溶液能用玻璃试剂瓶(内壁光滑),但不能用玻璃塞,因玻璃塞中裸露的二氧化硅与碱性溶液反应生成硅酸钠将瓶塞与瓶口粘在一起。
十一、硫及其重要化合物的特殊之处
(1)除去附着在试管内壁上的硫,可用热的NaOH溶液或CS2,但不能用酒精。
(2)SO2和Cl2等体积混合通入溶液中,氯气的漂白性不但不增强,反而消失。
(3)把SO2气体通入BaCl2溶液中,没有沉淀生成,但若通入NH3或加入NaOH溶液,或把BaCl2改成Ba(NO3)2均有白色沉淀生成,前两者生成BaSO3沉淀,后者生成BaSO4沉淀。
(4)浓盐酸和MnO2(足量)、浓H2SO4和Cu(足量)、浓HNO3和Cu(足量)反应时,随反应进行,产物会发生变化或反应停止。
(5)足量Zn和浓H2SO4反应,随着硫酸变稀,会继续产生氢气。
(6)C与浓硫酸反应产物的确定应按以下流程进行:
无水CuSO4确定水→品红溶液确定SO2→酸性KMnO4溶液除去SO2→品红溶液检验SO2是否除净→澄清石灰水检验CO2。
(7)浓硫酸具有氧化性,二氧化硫具有还原性,但二氧化硫可以用浓硫酸干燥,因为S元素在+4价和+6价之间没有中间价态,SO2与浓H2SO4不反应。
(8)SO2的“四大性质体现”
序号 | 实验现象 | 性质体现 |
① | 使含有酚酞的NaOH溶液褪色 | 酸性氧化物 |
② | 使品红溶液褪色,加热后又复原 | 漂白性 |
③ | 使溴水、酸性KMnO4溶液褪色 | 还原性 |
④ | 与H2S反应变浑浊 | 氧化性 |
十二、氮及其化合物的“八大思维盲点”
(1)NO只能用排水法或气囊法收集,NO2不能用排水法,可用排苯法收集。
(2)工业上制备的盐酸显黄色是因为溶有Fe3+,而浓HNO3显黄色是因为溶有NO2。
(3)NO2能被NaOH溶液吸收,NO单独不能被强碱溶液吸收,NO与NO2混合能被NaOH溶液吸收。
(4)NO2或NO与O2通入水的计算中常用到4NO+3O2+2H2O===4HNO3、
4NO2+O2+2H2O===4HNO3两个方程式,也可以利用n(元素化合价的变化),根据电子守恒进行计算。
(5)强氧化性酸(如HNO3、浓H2SO4)与金属反应不生成H2;金属和浓HNO3反应一般生成NO2,而金属和稀HNO3反应一般生成NO。
(6)实验室制备NH3,除了用Ca(OH)2和NH4Cl反应外,还可用浓氨水的分解(加NaOH固体或CaO)制取,而检验NH4+须用浓NaOH溶液并加热,用湿润的红色石蕊试纸检验生成的气体,以确定NH4+的存在。
(7)收集NH3时,把一团干燥的棉花放在试管口,以防止与空气对流;收集完毕,尾气处理时,应放一团用稀硫酸浸湿的棉花在试管口,以吸收NH3。
(8)浓盐酸和浓氨水反应有白烟生成,常用于HCl和NH3的相互检验。

- 全部评论(0)
