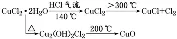化学实验综合题知识点总结
时间:2021-03-19 09:06 来源:未知 作者:化学自习室 点击:次 所属专题: 实验综合题
版权申明:凡是署名为“化学自习室”,意味着未能联系到原作者,请原作者看到后与我联系(邮箱:79248376@qq.com)!
一、高考定位
高考综合实验题知识容量大、命题素材新、考查角度广、综合程度高,纵观近几年全国卷中的综合实验题,考查的角度有仪器的识别与应用,实验装置的作用,实验操作的目的,物质的制备、除杂与分离,物质的性质探究与验证,实验现象的分析与描述,实验结论的评价与计算。
二、考点解析
1.常考实验仪器
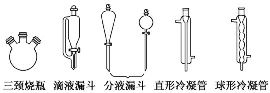
仪器名称 | 仪器简图 | 使用方法及注意事项 |
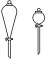
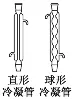
分液漏斗 |
| ①梨形分液漏斗:常用于有机物的萃取和互不相溶液体的分液 球形分液漏斗:常用于制气反应时添加液体 ②使用前要检查活塞、瓶塞处是否漏液 |
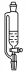
恒压漏斗 |
| ①常用于制气反应时添加液体,由于漏斗有恒压管(使反应容器与漏斗中的压强相等),更利于液体顺利滴入 ②使用前要检漏 |
烧瓶 |
| ①加热时可垫石棉网,也可水浴加热 ②蒸馏烧瓶用于液体的蒸馏或分馏,蒸馏时温度计的水银球位于蒸馏烧瓶的支管口处 ③烧瓶内放碎瓷片的目的是防止暴沸 |
三颈烧瓶 |
| ①三个瓶颈,一个装分液漏斗、一个装导气管(或冷凝管)、一个装温度计(或搅拌器) ②加热时需垫石棉网,且需要加入碎瓷片 |
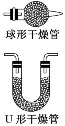
干燥管 |
| ①除气体杂质:球形干燥管内盛放固体试剂,除去气体中的杂质,“大口进、小口出” ②检验物质:利用气体与固体物质反应,检验某种气体,如用无水CuSO4检验水蒸气 ③组成防倒吸装置:将球形干燥管的小口刚刚浸入水溶液中,用于吸收极易溶于水的气体 |
冷凝管 |
| ①直形冷凝管:用于气态物质的冷凝液化,通常斜放着连接蒸馏烧瓶 ②球形冷凝管:用于气态物质的冷凝回流,可提高反应物的转化率,通常竖立于圆底烧瓶或三颈烧瓶上 ③冷凝水从冷凝管的下口进、上口出 |
2.常考实验操作
从溶液中得到晶体的操作 | 蒸发浓缩→冷却结晶→过滤→洗涤(包括水洗、冰水洗、热水洗、乙醇洗等)→干燥 |
蒸发结晶的操作 | 将溶液转移到蒸发皿中加热,并用玻璃棒不断搅拌,待有大量晶体出现时停止加热,利用余热蒸干剩余水分 |
测溶液pH的操作 | 取一小块pH试纸放在表面皿或玻璃片上,用蘸有待测溶液的玻璃棒点在(或用胶头滴管吸取待测溶液滴在)试纸中部,观察试纸颜色变化,并与标准比色卡对比 |
滴定操作 | 滴定时,左手控制滴定管活塞,右手振荡锥形瓶,眼睛注视锥形瓶内溶液颜色的变化 |
证明沉淀完全的操作 | 静置,取沉淀后的上层清液,加入××试剂(沉淀剂),若没有沉淀生成,说明沉淀完全 |
洗涤沉淀的操作 | 沿玻璃棒向漏斗(过滤器)中的沉淀上加蒸馏水至没过沉淀,静置使其全部滤出,重复操作数次 |
检验沉淀是否洗涤干净的操作 | 取最后一次洗涤液,加入××试剂(根据沉淀可能吸附的杂质离子,选择合适的检验试剂),若没有××(特征现象)出现,证明沉淀已洗涤干净 |
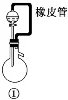
3.常考实验装置的作用
实验装置 | 主要作用 |
| ①中橡皮管的作用:平衡压强,使液体能顺利滴下;降低液体体积对气体体积测量的干扰 |
②的作用:干燥或除去气体中的杂质 | |
③的作用:吸收尾气,防止污染空气 | |
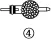
④的作用:干燥气体或吸收气体;防止空气中二氧化碳、水蒸气对实验的影响 | |
| ⑤的作用:安全瓶,防止瓶内压强过大 |
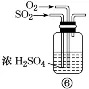
⑥的作用:混合气体;干燥气体;通过观察气泡速率控制流量 | |
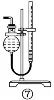
⑦的作用:测量气体体积。读数时注意:装置冷却到室温,上下移动量气管使两液面高度一致,平视量气管内凹液面最低处读出数值 | |
4.常考经典实验装置分析
实验目的 | 实验装置 | 注意事项 |
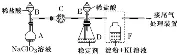
探究硫酸亚铁的分解产物 |
| ①通入干燥的N2是为了排除装置中的空气 ②根据实验后反应管中残留固体为红色粉末,其分解的化学方程式为2FeSO4 ③欲检验SO2和SO3,必须先用C中BaCl2溶液检验SO3,再用D中的品红溶液检验SO2 |
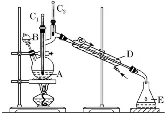
合成正丁醛 |
| ①反应原理: CH3CH2CH2CH2OH→(Na2Cr2O7H2SO4、加热)CH3CH2CH2CHO ②温度计C1测的是反应液的温度,温度计C2测的是蒸气的温度 |
ClO2的制备、吸收、释放和应用 |
| ①反应原理:2NaClO3+4HCl===2ClO2↑+Cl2↑+2NaCl+2H2O ②F中导管应该长进短出 ③ClO2在D中被稳定剂完全吸收生成NaClO2,此时F中溶液的颜色不变,则装置C的作用是吸收Cl2 |
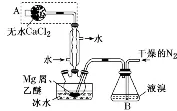
制备无水MgBr2(强吸水性) |
| ①通入干燥的N2是为了防止镁屑与氧气反应,同时依靠气流将溴蒸气带入反应体系 ②冰水浴的目的是防止液溴和乙醚的挥发 ③装置A的作用是防止外界水蒸气进入,因为MgBr2有强吸水性 |
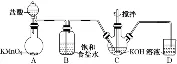
制备KClO溶液 |
| ①B的作用是除去HCl,没有b装置KClO的产率会下降 ②为了减少副反应,C中加冰水浴 |
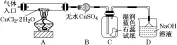
制备无水氯化铁 |
| ①制备无水氯化铁,分液漏斗中加入浓盐酸、烧瓶中加入二氧化锰 ②B装置内液体为饱和食盐水,吸收Cl2中的HCl,C装置内液体为浓H2SO4,干燥Cl2 |
热分解CuCl2·2H2O制备CuCl |
| ①反应原理
②反应结束后先熄灭酒精灯,冷却,停止通入HCl,继续通入氮气是为了防止生成的CuCl被氧化 |
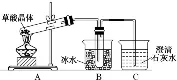
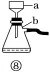
检验草酸晶体(易升华)的分解产物 |
| b的作用是冷凝草酸蒸气,防止草酸进入C干扰分解产物CO2的检验 |
三、解题流程
(一)化大为小,从4个层面上理清实验
面对实验大题,考生常感到“老虎吃天、无从下口”,心生畏惧感。解实验大题,需具备化整为零、化大为小的思维。通常的做法就是先明确实验目的、原理,再理清实验装置、步骤及操作规范,后描述现象,得出结论。这样,将实验分割成几个板块,先个个击破,再系统思维,题点就会呈现,思路就会清晰。可按以下步骤进行:
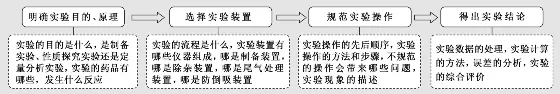
(二)注重细节,从规范表达上减少失分
“不是不会答,而是答不范、答不美”是实验表述题常见的失分原因,怎样答“范”答“美”,答出“逻辑”,将常见答题用语和答题“套路”分类汇总,教你在答实验表述题时做到有话可说、有话会说。
规范语言描述
1.实验现象的描述
类型一 有关溶液的现象描述(五大类)
① | 颜色由……变成…… |
② | 液面上升或下降(形成液面差) |
③ | 溶液变浑浊或生成(产生)……(颜色)沉淀 |
④ | 溶液发生倒吸 |
⑤ | 产生大量气泡(或有气体从溶液中逸出)等 |
类型二 有关固体物质的现象描述(四大类)
① | ……(固体)表面产生大量气泡 |
② | ……(固体)逐渐溶解 |
③ | ……(固体)体积逐渐变小(变细) |
④ | ……(固体)颜色由……变成…… |
类型三 有关气体的现象描述(三大类)
① | 生成……色(味)气体 |
② | 气体由……色变成……色 |
③ | 气体颜色先……后……(加深、变浅、褪色等) |
2.实验操作的描述
(1)判断滴定终点的答题规范
①答题模板
当滴入最后一滴×××标准溶液后,溶液由×××色变成×××色,或溶液×××色褪去,且半分钟内不恢复原来的颜色
②注意问题

(2)描述离子检验现象的答题规范(以“Cl-检验”为例)

(3)判断沉淀是否洗涤干净的答题规范
取少许最后一次的洗涤滤液于试管中,滴入少量××溶液(试剂),若出现×××现象,表明沉淀已洗涤干净。
解答这类试题的三个关键得分点:

(4)气体检验的答题规范(以“用澄清石灰水检验CO2气体”为例)

(5)检查装置气密性的答题规范
①微热法检查
封闭(关闭活塞、导管末端插入盛水的烧杯中等)、微热(双手捂热或用酒精灯稍微加热)、气泡(观察到导管口有气泡逸出)、水柱(移开双手或停止加热,观察到导管中液面上升形成一段稳定的水柱)。
②液差法检查
封闭(关闭活塞或用止水夹夹住橡皮管等)、液差(向×××容器中加水,使×××和×××形成液面差,停止加水,放置一段时间,液面差保持不变)。
熟悉答题“套路”
1.“装置或试剂作用”套路
作用 | 思考方向 |
有机物制备装置中长导管(或冷凝管)的作用 | 冷凝回流、导气 |
有机物分离提纯过程中加无水氯化钙的作用 | 干燥(除水) |
固液加热型制气装置中恒压分液漏斗上的支管的作用 | 保证反应器(一般为圆底烧瓶)内气压与恒压分液漏斗内气压相等(平衡气压),使分液漏斗中的液体易于滴下 |
温度计的使用方法 | 蒸馏时温度计水银球与蒸馏烧瓶的支管口相平,测定馏分的温度;制乙烯时温度计水银球插在反应物液面以下(不能接触瓶底),测定反应液的温度 |
2.“操作目的或原因”套路
目的或原因 | 思考方向 |
沉淀水洗的目的 | 除去××(可溶于水)杂质 |
沉淀用乙醇洗涤的目的 | A.减小固体的溶解度; B.除去固体表面吸附的杂质; C.乙醇挥发带走水分,使固体快速干燥 |
冷凝回流的作用及目的 | 防止××蒸气逸出脱离反应体系,提高××物质的转化率 |
控制溶液pH的目的 | 防止××离子水解;防止××离子沉淀;确保××离子沉淀完全;防止××溶解等 |
加过量A试剂的原因 | 使B物质反应完全(或提高B物质的转化率)等 |
温度不高于××℃的原因 | 温度过高××物质分解(如H2O2、浓硝酸、NH4HCO3等)或××物质挥发(如浓硝酸、浓盐酸)或××物质氧化(如Na2SO3等)或促进××物质水解(如AlCl3等) |
减压蒸馏(减压蒸发)的原因 | 减小压强,使液体沸点降低,防止××物质受热分解(如H2O2、浓硝酸、NH4HCO3等) |
蒸发、反应时的气体氛围 | 抑制××离子的水解(如加热蒸发AlCl3溶液时需在HCl气流中进行,加热MgCl2·6H2O得MgCl2时需在HCl气流中进行等) |
配制某溶液前先煮沸水的原因 | 除去溶解在水中的氧气,防止××物质被氧化 |
反应容器中和大气相通的玻璃管的作用 | 指示容器中压强大小,避免反应容器中压强过大 |
3.“废液处理”套路
废液为酸或碱 | 采用中和法 |
废液为氧化剂或还原剂 | 采用氧化还原法 |
废液含重金属离子 | 采用沉淀法 |
废液含有机物 | 采用萃取回收法等 |
4.无机物制备综合实验的思维方法
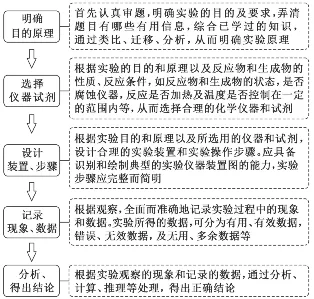
5.有机物制备实验题的解题模板
分析制备流程 |
|
熟悉重要仪器 |
|
依据有机反应特点作答 | ①有机物易挥发,反应中通常采用冷凝回流装置,以提高原料的利用率和产物的产率。 ②有机反应通常都是可逆反应,且易发生副反应,因此常使价格较低的反应物过量,以提高另一反应物的转化率和产物的产率,同时在实验中需要控制反应条件,以减少副反应的发生。 ③根据产品与杂质的性质特点,选择合适的分离提纯方法。 |
6.性质探究实验的注意事项
(1)在离子检验、气体成分检验的过程中,要严格掌握检验的先后顺序,防止各成分检验过程中的相互干扰。
(2)若有水蒸气生成,先检验水蒸气,再检验其他成分,如C和浓H2SO4的反应,产物有SO2、CO2和H2O(g),通过实验可检验三种气体物质的存在,但SO2、CO2都要通过溶液进行检验,对检验H2O(g)有干扰。
(3)对于需要进行转化才能检验的成分,如CO的检验,要注意先检验CO中是否含有CO2,如果有CO2,应先除去CO2再对CO实施转化,最后再检验转化产物CO2,如HOOC—COOH CO2↑+CO↑+H2O↑中CO的检验。
CO2↑+CO↑+H2O↑中CO的检验。
(4)要重视试剂名称的描述,如有些试剂的准确描述为:无水硫酸铜、澄清石灰水、酸性高锰酸钾溶液、浓硫酸、饱和NaHCO3溶液、NaOH溶液等。此外还应注意某些仪器的规格。
7.定量测定实验
1.常见的考查角度
从近几年高考试题来看,综合实验题涉及的计算主要有:
(1)测定样品产物、废旧物质的产品回收率、物质中某组分的质量分数或结晶水数目等。
(2)利用中和滴定、氧化还原滴定及沉淀滴定原理进行物质的量浓度、物质的量和质量的有关计算。
2.常用的计算公式
(1)n=m/M,n=V/Vm,n=c v(aq)
(2)物质的质量分数(或纯度)=该物质的质量混合物的总质量×100%
(3)产品产率=产品的实际产量产品的理论产量×100%
(4)物质转化率=参加反应的原料量加入原料的总量×100%
3.常用的计算方法(关系式法)
关系式法常应用于一步反应或分多步进行的连续反应中,利用该法可以减少不必要的中间运算过程,避免计算错误,并能迅速准确地获得结果。一步反应可以直接找出反应物与目标产物的关系;在多步反应中,若第一步反应的产物,是下一步反应的反应物,可以根据化学方程式,将该物质作为“中介”,找出已知物质和所求物质之间量的关系。利用这种方法解题的关键是建立已知物质和所求物质之间的关系式。
4.一种典型的实验方法(碘量法)
化学实验中的计算常与滴定实验相结合进行考查。碘量法是氧化还原滴定中应用较为广泛的一种方法,在近年的高考试题中多次出现。I2可作氧化剂,能被Sn2+、H2S等还原剂还原;I-可作还原剂,能被IO3-、Cr2O72-、MnO4-等氧化剂氧化。碘量法分为直接碘量法和间接碘量法,直接碘量法是用碘滴定液直接滴定还原性物质的方法,在滴定过程中,I2被还原为I-;高考试题中经常涉及的是间接碘量法(又称滴定碘法),它是利用I-的还原性与氧化性物质反应产生I2,遇淀粉溶液显蓝色,再加入Na2S2O3标准溶液与I2反应,滴定终点的现象为蓝色消失且半分钟内不变色,从而测出氧化性物质的含量。例如用间接碘量法测定混合气中ClO2的含量,有关的离子方程式为2ClO2+10I-+8H+===2Cl-+5I2+4H2O和I2+2S2O32-===2I-+S4O62-,得关系式2ClO2~5I2~10S2O32-,然后根据已知条件进行计算。

- 全部评论(0)


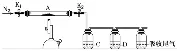
 Fe2O3+SO2↑+SO3↑
Fe2O3+SO2↑+SO3↑