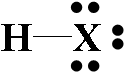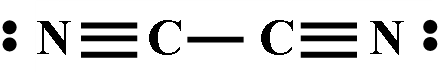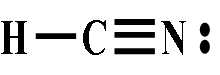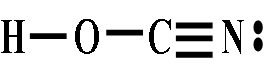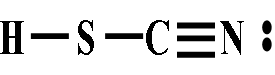氰、氢氰酸和氰酸等物质性质比较
时间:2025-09-29 15:26 来源:未知 作者:化学自习室 点击: 次 所属专题: 氰化物
版权申明:凡是署名为“化学自习室”,意味着未能联系到原作者,请原作者看到后与我联系(邮箱:79248376@qq.com)!
一、拟卤素
1、涵义
某些原子团形成的分子,与卤素单质分子的性质相似,它们的阴离子与卤素阴离子的性质也相似,所以常称它们为拟卤素。
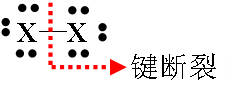
2、重要的拟卤素有氰(CN)2、硫氰(SCN)2、硒氰(SeCN)2和氧氰(OCN)2。
比较 物质 | 单质 | 酸 | 盐 | ||
化学式 | 结构式 | 结构简式 | 化学式 | ||
卤素 | X2 |
|
| KX | |
拟 卤 素 | 氰 | (CN)2 |
|
| KCN |
氧氰 | (CNO)2 |
|
| KNO | |
硫氰 | (SCN)2 |
|
| KSCN | |
硒氰 | (SeCN)2 |
|
| KSeCN | |
3、与氢卤酸相应的酸、拟卤离子

二、氰、氢氰酸和氰化物
1、氰
⑴ 物理性质:
氰(CN)2:无色气体、可燃气体,有苦杏仁味,极毒。m.p.-27.9℃ b.p. -21.2℃;
溶于水[0℃时1体积的H2O溶解4体积的(CN)2]、乙醇、乙醚。燃烧时发生带有蓝色边缘的桃红色火焰。
⑵ 化学性质:
①热稳定性:纯净时具有相当高的热稳定性(800℃)。
但若有痕量杂质,一般能于300~500℃温度下聚合成不溶于水的白色固体—多聚氰(CN)x 。
多聚氰(CN)x 在800℃以上转化为(CN)2,850℃转化为CN自由基。

三聚氰胺最早被三聚氰胺李比希于1834年合成,早期合成使用双氰胺法:由电石(CaC2)制备氰胺化钙(CaCN2),氰胺化钙水版解后二聚生成双氰胺(Dicyandiamide),再加热分解制备三聚氰胺。与该法相比,尿素法成本低,尿素以氨气为载体,硅胶为催化剂,在380-400℃温度下沸腾反应,先分解生成氰酸,并进一步缩合生成三聚氰胺。
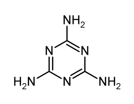
三聚氰胺结构式
三聚氰胺制备:6 CO(NH2)2 → C3N6H6 + 6 NH3 + 3 CO2
② 氰在水或碱溶液中发生歧化反应:
(CN)2+H2O→HCN+HCN,
(CN)2+2OH-→CN-+OCN-+H2O
③ 长时间在水中,(CN)2慢慢生成HCN、HCN、碳酰胺(即脲或尿素)(H2N)2CO、乙二酰二胺(即草酰胺)(H2N—CO—CO—NH2)和草酸铵(NH4)2C2O4等。
H2N—CO—CO—NH2+2H2O=(NH4)2C2O4
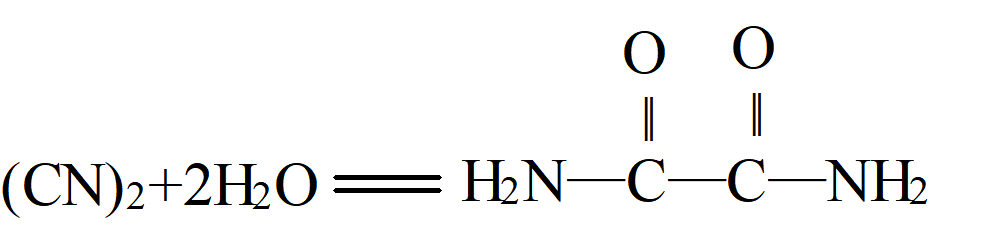
⑶ 制备反应:
2HCN(g)+1/2 O2(空气)![]() (CN)2+2H2O
(CN)2+2H2O
2HCN(g)+NO2→(CN)2+NO+H2O
用CuSO4或CuCl2溶液跟NaCN或KCN反应,
2Cu2++6CN-=2[Cu(CN)2]-+(CN)2
也可以由加热AgCN或Hg(CN)2与HgCl2共热而制取。
2AgCN 2Ag+(CN)2
2Ag+(CN)2
Hg(CN)2+HgCl2 Hg2Cl2+(CN)2↑
Hg2Cl2+(CN)2↑
2、氢氰酸和氰化物
⑴ 氰化氢HCN
① 物理性质:易流动的无色液体,极毒!ρ=0.6876g/㎝3, m.p.-13.4℃ b.p. 25.6℃,极易挥发;与水、乙醇或乙醚任何比例混溶。
在二次世界大战中,德国法西斯在波兰的奥斯威辛集中营,用易挥发的氢氰酸杀害了几百万难民。
② 用途:工业上用于制备丙烯腈和丙烯酸树脂等;农业上用作杀虫剂,用以熏蒸仓库、果树、苗木等。
③化学性质:氢氰酸是弱酸(比HF还弱),但是,纯液态的HCN是强酸。氢氰酸的盐叫做氰化物。氰化物与稀硫酸等作用可以得到HCN。与NaOH反应生成NaCN和水
④制备:甲烷、氨气、氧气生成HCN和水
2CH4+2NH3+3O2==2HCN+6H2O 催化剂,800摄氏度
(2)氰化物(有剧毒)
Ⅰ、CN--的强水解性:碱金属的氰化物易溶于水,并在水中强烈水解而使溶液呈强碱性。
CN-+H2O HCN+OH-
HCN+OH-
Ⅱ、CN-的强络合性:
CN-极易与过渡金属及锌、镉、银、汞形成稳定的配离子,如[Fe(CN)6]4-、[Hg(CN)4]2-……
NaCN和KCN被广泛地用在从矿物中提取金和银。
4Au+8NaCN+2H2O+O2=4Na[Au(CN)2]+4NaOH,
AgCN+CN-=[Ag(CN)2]-
Ⅲ、CN-的还原性[较易于氧化为(CN)2或OCN-]:
①氰化物的处理:
NaClO+CN-=Na++OCN-(无毒)+Cl-,
5Cl2+10OH-+2CN-=2HCO3--+N2↑+10Cl-+4H2O
FeSO4+6CN-=[Fe(CN)6]4--(无毒)+SO42-
三、硫氰和硫(代)氰酸盐
1、硫氰(SCN)2
⑴物理性质:
白色晶体;在常温下,硫氰为黄色油状液体,不稳定,易挥发,m.p. 271~276K。在水溶液中的性质类似溴。将硫氰酸银悬浮于乙醚内,用碘或溴处理可以得到硫氰。
2AgSCN+I2=2AgI+(SCN)2
⑵ 化学性质:
稳定性:中等程度的稳定性。(SCN)2在熔化后,逐渐聚合成不溶性的、砖红色的聚合物(SCN)x 。但它在CCl4或HAc中却很稳定,而硫氰的CS2或己烷稀溶液却部分离解为SCN单体。
硫氰易被水解。
氧化还原性:(中等程度)
(SCN)2+2I-=2SCN-+I2,
(SCN)2+2S2O32--=2SCN-+S4O6-2-,
(SCN)2+H2S=2H++2SCN-+S↓
⑶ 用途:硫氰(SCN)2是分析化学上的重要氧化剂,用于测定化合物的不饱和度(类似I2的作用)。
2、硫氰化氢、硫(代)氰酸和硫氰酸盐
(1)硫氰化氢
硫氰化氢HSCN是无色、极易挥发的液体,略有毒性。在常温下,迅速分解。易溶于水,水溶液呈强酸性。
能聚合。与烯烃作用生成酯类。
(正)硫氰酸酯R—S—C≡N ,一般是带有葱气味的液体;异硫氰酸酯R—N=C=S ,常称芥子油,是带有异常刺激性气味的液体。
这些酯类用于制备药物和杀虫剂。
⑵硫(代)氰酸和硫氰酸盐
①硫氰酸与异硫氰酸:HSCN的水溶液叫做硫(代)氰酸,它的同分异构体HNCS叫做异硫氰酸。游离态酸是二者的互变异构混合物,尚无法使之分离开来。
H—S—C≡N(正)硫氰酸 H—N=C=S 异硫氰酸
H—N=C=S 异硫氰酸
SCN-在酸性溶液中,就存在上述互变异构混合物。
②硫氰酸钾和硫酸氢钾反应,可以得到硫氰酸:
KSCN+KHSO4=HSCN+K2SO4]
③、SCN--作配位体:它既可用S原子上的孤电子对 即
即 又可用N原子上的孤电子对,
又可用N原子上的孤电子对, ,即
,即![]() 作为电子给予体。
作为电子给予体。
当它与第一系列过渡元素配位时,通过N原子成键;当它与第二、第三系列过渡元素配位时,则通过S原子成键。例如,[Fe(SCN)x]3-x (x=1~6),[Hg(SCN)4]2-……
四、氧氰、氰酸及其盐
1、氧氰(OCN)2
电解氰酸钾,在阳极上得到氧氰。游离的氧氰尚未制得,它只存在于溶液中。
2OCN-![]() (OCN)2+2e-
(OCN)2+2e-
2、氰酸及其盐
氰酸
①同分异构体及互变异构体:
氰酸H—O—C≡N、异氰酸H—N=C=O、雷酸H—O—N=C,是同分异构体。
H—N=C=O(异氰酸) H—O—C≡N(氰酸),←平衡强烈向左移动
H—O—C≡N(氰酸),←平衡强烈向左移动
游离的氰酸是(正)氰酸和异氰酸的混合物,因两者互变异构,未曾分开(但其酯类则有两种形式);
无色有毒液体,易挥发,有辣味。ρ=1.140g/㎝3, m.p.-86.8℃ b.p. 23.5℃。在气体或乙醚溶液中以异氰酸为主。
②可由固体的三聚氰酸加热分解而制得。
⑵性质:
①水溶液显较强的酸性:异氰酸(HNCO)Ka=3.47×10--4
②在水溶液中迅速水解为NH3和CO2。迅速加热可引起爆炸。
HCN+H2O=NH3+CO2,
HCN+H2O=HCO2NH2,
HCO2NH2+H2O=NH4HCO3
③氰酸盐较稳定,但在水溶液中OCN--较易水解。
例如,KOCN约700℃分解,溶于水,不溶于乙醇。
KCN+2H2O=NH3+KHCO3
制取KOCN的反应:KCN+PbO=KOCN+Pb
(用酒精萃取,得无色KOCN)

- 全部评论(0)