题型攻克七:选择题-带数据的离子推理题
时间:2021-04-12 08:29 来源:高中化学教学研究 作者:张德金 点击: 次 所属专题: 离子推断
版权申明:凡是署名为“化学自习室”,意味着未能联系到原作者,请原作者看到后与我联系(邮箱:79248376@qq.com)!
示例一:
某无色溶液甲中仅含有下列离子中的几种(不考虑水的电离以及离子的水解)。
阳离子:K+、Al3+、Fe3+、Ba2+、NH4+,
阴离子:Cl-、CO32-、HCO3-、SO42-。
取100mL 溶液甲并分成两等份进行如下实验(假设每步完全反应):

下列说法正确的是:
A、由①可知,原溶液中存在的离子有NH4+,浓度为0.2mol•L-1
B、实验②中生成沉淀的离子方程式为2AlO2-+CO2+3H2O=2Al(OH)3↓+CO32-
C、通入过量CO2充分反应后,需将反应后的混合溶液加热再过滤,其目的主要是为了加快反应进行
D、某同学通过分析认为该溶液中一定存在K+,这位同学利用的方法是电荷守恒
答案:D
推理过程:
(1)根据题干中的无色溶液,推理出溶液中没有Fe3+。
阳离子:K+、Al3+、Ba2+、NH4+,阴离子:Cl-、CO32-、HCO3-、SO42-。
(2)根据流程①:气体为NH3,n(NH3)=224mL/(22400mL•mol-1)=0.02mol。
推理出有NH4+,且为0.02mol。
阳离子:K+、Al3+、Ba2+、NH4+,阴离子:Cl-、CO32-、HCO3-、SO42-。
(3)根据流程②:过量CO2生成HCO3-,不会产生BaCO3沉淀。所以生成的沉淀是Al(OH)3,灼烧后为Al2O3。n(Al2O3)=1.02g/(102g•mol-1)=0.01mol。
推理出有Al3+,且为0.02mol。
阳离子:K+、Al3+、Ba2+、NH4+,阴离子:Cl-、CO32-、HCO3-、SO42-。
(4)根据流程③:推理得到的沉淀为BaSO4,n(BaSO4)= 11.65g/(233g•mol-1)=0.05mol。
推理出有SO42-,且为0.05mol。
阳离子:K+、Al3+、Ba2+、NH4+,阴离子:Cl-、CO32-、HCO3-、SO42-。
(5)根据离子共存:溶液中有Al3+,则不存在CO32-、HCO3-。溶液中有SO42-,则不存在Ba2+。
阳离子:K+、Al3+、NH4+,阴离子:Cl-、SO42-。
(6)根据溶液的电荷守恒:Al3+、NH4+带的正电荷数为0.08mol,SO42-带的正电荷数为0.1mol,推理出K+最少为0.02mol。
阳离子:K+、Al3+、NH4+,阴离子:Cl-、SO42-。
示例二
某试液中只可能含有K+、NH4+、Fe2+、Al3+、Cl-、SO42-、CO32-、AlO2-中的若干种离子。离子浓度均为0.3mol•L-1。某同学进行了如图实验:
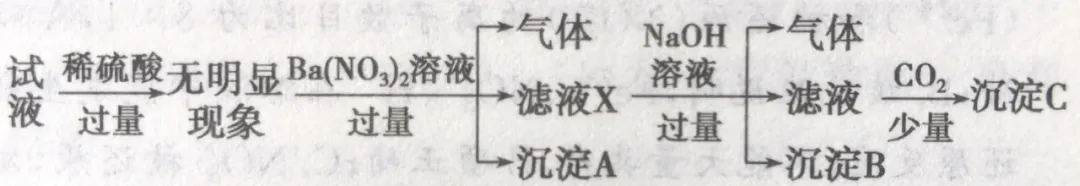
下列说法正确的是:
A、无法确定原试液中是否含有Al3+、Cl-
B、原试液中存在的离子为NH4+、Fe2+、Cl-、SO42-、
C、滤液X中大量存在的阳离子有NH4+、Fe2+、Ba2+
D、无法确定沉淀C的成分
答案:B
推理过程:
(1)根据“稀硫酸过量,无明显现象”,推理出溶液中没有CO32-。但不能确定AlO2-肯定没有。
结果为:K+、NH4+、Fe2+、Al3+、Cl-、SO42-、AlO2-。
(2)根据“Ba(NO3)2溶液过量”有“气体”,推理出气体为NO,溶液中有Fe2+。
结果为:K+、NH4+、Fe2+、Al3+、Cl-、SO42-、AlO2-。
(3)根据“Ba(NO3)2溶液过量”有“沉淀”,推理出沉淀为BaSO4。但不能推理出溶液中肯定有SO42-。
结果为:K+、NH4+、Fe2+、Al3+、Cl-、SO42-、AlO2-。
(4)根据“NaOH溶液过量”有“气体”,推理出气体为NH3,溶液中有NH4+。
结果为:K+、NH4+、Fe2+、Al3+、Cl-、SO42-、AlO2-。
(5)根据根据“NaOH溶液过量”有“沉淀”,推理出沉淀为Fe(OH)3。
结果为:K+、NH4+、Fe2+、Al3+、Cl-、SO42-、AlO2-。
(6)根据“CO2少量”先判断溶液中会出现CO32-,肯定能产生BaCO3沉淀。确定“沉淀”中肯定有BaCO3。然后推理无法确定“沉淀”中有Al(OH)3。从而无法确定Al3+、AlO2-。
结果为:K+、NH4+、Fe2+、Al3+、Cl-、SO42-、AlO2-。
(7)根据离子共存:推理AlO2-肯定不存在。
结果为:K+、NH4+、Fe2+、Al3+、Cl-、SO42-。
(8)根据电荷守恒:推理Cl-、SO42-肯定存在且均为0.3mol•L-1。
结果为:K+、NH4+、Fe2+、Al3+、Cl-、SO42-。
(9)根据电荷守恒:推理K+、Al3+肯定不存在。
结果为:NH4+、Fe2+、Cl-、SO42-。
【练习】
1、某溶液可能含有Cl-、SO42-、CO32-、NH4+、Fe3+、Al3+和K+。取该溶液100 mL,加入过量NaOH溶液,加热,得到0.02 mol 气体,同时产生红褐色沉淀;过滤,洗涤,灼烧,得到1.6 g 固体;向上述滤液中加足量BaCl2溶液,得到4.66 g 不溶于盐酸的沉淀。由此可知原溶液中( )
A.至少存在5种离子
B.Cl-一定存在,且c(Cl-)≥0.4mol·L-1
C.SO42-、NH4+一定存在,Cl-可能不存在
D.CO32-、Al3+一定不存在,K+可能存在
2、某未知溶液X可能含有Al3+、Na+、NH4+、Cl-、CO32-、SO42-中的若干种,取该溶液进行如下实验,若实验过程中所加试剂均过量,产生的气体全部逸出。则下列说法正确的是( )
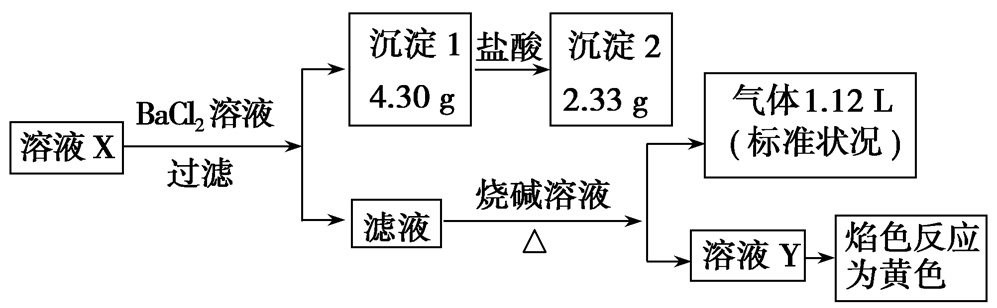
A.原溶液中一定存在Na+,可能存在Cl-
B.原溶液中一定存在CO32-、SO42-、NH4+,且均为0.01 mol
C.原溶液中可能存在Na+,n(Cl-)≥0.01mol
D.原溶液中一定不存在Al3+、Cl-
【练习答案】
1、答案:B
解析:根据加入过量NaOH溶液,加热,得到0.02 mol 气体,说明有NH4+,物质的量为0.02 mol,同时产生红褐色沉淀,说明有Fe3+,而且为0.02 mol,则没有CO32-;根据不溶于盐酸的4.66 g 沉淀,说明有SO42-,且为0.02 mol,则根据电荷守恒可知一定有Cl-,至少有0.04 mol,B正确。
2、答案:C
解析:滤液中加入了烧碱溶液,通过焰色反应不能确定原溶液中是否存在Na+;加入BaCl2溶液生成沉淀1,说明原溶液中至少含有CO32-、SO42-中的一种,沉淀1部分溶于盐酸,所以沉淀1一定是BaSO4、BaCO3的混合物,故原溶液中一定存在CO32-、SO42-,CO32-和Al3+不能大量共存,所以原溶液中一定不存在Al3+;沉淀2为硫酸钡沉淀,其物质的量为0.01 mol,CO32-的物质的量为0.01 mol;向所得滤液中加入氢氧化钠溶液,生成了气体,则该气体应为氨气,证明原溶液中一定含有NH4+,其物质的量为0.05 mol,CO32-、SO42-所带负电荷的物质的量之和为0.01 mol×2+0.01 mol×2=0.04 mol,根据电荷守恒,原溶液中一定存在Cl-,不能确定是否存在Na+,所以n(Cl-)≥0.01mol。

- 全部评论(0)
