题型攻克八:电化学的选择题和填空题
时间:2021-04-09 17:03 来源:高中化学教学研究 作者:小闪哥 点击: 次 所属专题: 电化学选择题07
版权申明:凡是署名为“化学自习室”,意味着未能联系到原作者,请原作者看到后与我联系(邮箱:79248376@qq.com)!
一、基础知识:
初中电池知识:电子的移动方向与电流的方向相反,负极流出电子,正极流入电子。
背景知识:氧化还原反应的基本理论。
1、对原电池结构、电解池结构的基本理解
(1)对于原电池:
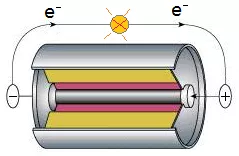
负极:还原剂失去电子给电极,电子从电池内部流出。
还原剂-ne-+……=氧化产物+……
正极:氧化剂从电极得到电子,电子从电池外部流入。
氧化剂+ne-+……=还原产物+……
原电池主动发生氧化还原反应。
(2)对于电解池:
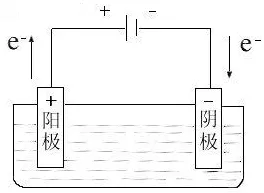
阴极:与电源负极相连,电子从外部进入,发生得电子反应。
阳离子+ne-+……=还原产物+……
阳极:与电源正极相连,电子从电极流出,发生失电子反应。
阴离子-ne-+……=氧化产物+……
电解池被动发生氧化还原反应。
2、电解池的电极反应中的特殊问题:
(1)有些离子在水溶液中不能被电解。
阳离子中的K+、Ca2+、Na+、Mg2+、Al3+、Ba2+……
阴离子中的一些含氧酸根、F-……
(2)阳极是金属时(Pt、Au除外),金属会反应,溶液中的阴离子不再被电解。
阳极:金属-ne-+……=氧化产物+……
(3)电镀与电解精炼:
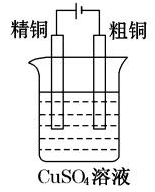
电解精炼时,带杂质的金属放在阳极,纯金属放在阴极。

电镀时,镀在表面的金属放在阳极,溶液要用此金属的电解质溶液,被镀的物品放在阴极。
3、充电电池的特殊性
充电时,原电池的电极反应发生逆向反应。
原电池的负极放电时失去电子,充电时得到电子,需要连接外电源的负极。
原电池的正极放电时得到电子,充电时失去电子,需要连接外电源的正极。
充电时,负极接负极,正极接正极。对应电极的反应与放电时相反。
4、溶液环境对反应的影响
酸性、碱性、中性、熔融等,对电极反应的书写有影响。
例如:甲醇燃料电池的负极反应:
(1)在酸性溶液中:CH3OH-6e-+H2O=CO2+6H+
(2)在碱性溶液中:CH3OH-6e-+8OH-=CO32-+6H2O
(3)在中性溶液中:CH3OH-6e-+H2O=CO2+6H+
(4)在饱和Na2CO3溶液中:CH3OH-6e-+2H2O+7CO32-=8HCO3-
(5)在熔融CaO中:CH3OH-6e-+3O2-=CO2+2H2O
(6)在熔融Na2CO3中:CH3OH-6e-+3CO32-=2H2O+4CO2
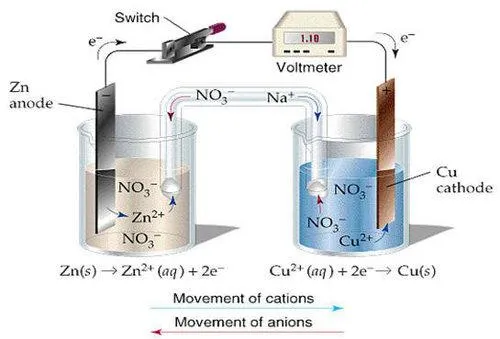
5、离子移动方向的推理技巧
阴离子的移动方向与电子的移动方向保持同向,形成闭合回路。
阳离子的移动方向与电子的移动方向相反。
6、膜的知识
(1)膜的种类
①阳离子交换膜:允许阳离子双向自由穿过。一般以-SO3-等的盐,如磺酸型钠盐,固定基团是磺酸根,解离离子是钠离子。阳离子交换膜带负电荷,在通电时,带有正电荷的阳离子可以通过阳膜,而阴离子因为同性排斥而不能通过。
②阴离子交换膜:允许阴离子双向自由穿过。一般以-NH3+等的盐。
③质子交换膜:允许H+双向自由穿过。
(2)功能:在放电或电解时可以用于分离离子、改善或保持溶液的纯净。
例:可用氨水作为吸收液吸收工业废气中的SO2,当吸收液失去吸收能力时,可通过电解法使吸收液再生而循环利用(电极均为石墨电极),并生成化工原料硫酸。其工作示意图如图所示:
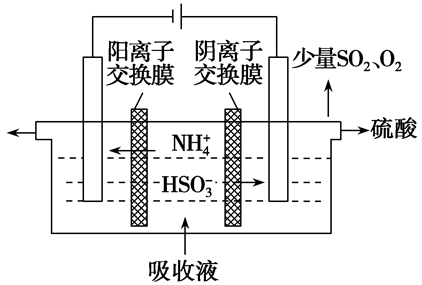
阳极反应式为:HSO3--2e-+H2O=3H++SO42-
阴极反应式为:2H++2e-=H2↑
左侧溶液中继续发生NH4+变为NH3•H2O的反应。
7、电极电势的知识
(1)氧化性强的物质所对的电极的电势为高电势,还原性强的物质所对的电极的电势为低电势。
(2)电势的高低既与物质的还原能力高低、氧化能力高低有关,也有溶液的电解质浓度有关。
二、考查难点:
1、增加非水体系
如熔融盐体系、有机溶剂体系、离子液体体系等。
不能用H+、OH-、H2O的相互变化书写电极方程式,要用电池的电解质中提供的离子书写。
例:某离子液体是一种室温熔融盐,为非水体系。由有机阳离子、Al2Cl7-和AlCl4-组成的离子液体作电解液时,可在钢制品上电镀铝。已知电镀过程中不产生其他离子且有机阳离子不参与电极反应。
分析:
阳极反应式为:Al-3e-+7AlCl4-=4Al2Cl7-
阴极反应式为:4Al2Cl7-+3e-=Al +7AlCl4-
2、考查锂电池的三个特点
①负极是单质Li。
②溶液中一般传导的是Li+。
③电解质溶液不能用水、醇、酸等。
3、增加价态判断考查
对于不容易判断价态的元素,可以用整体法或电荷守恒法判断得失电子数。
(1)例:酸性燃料电池的燃料为C3H5OH,写出负极的电池方程式。
C3H5OH-16e-+5H2O =3CO2↑+16H+
先根据质量守恒配平,再用电荷守恒可以推理出C3H5OH失去16e-。
(2)例:如图装置(I)为一种可充电电池的示意图,其中的离子交换膜只允许K+通过,该电池放电时的化学反应方程式为:2K2S2+KI3=K2S4+3KI。装置(Ⅱ)为电解池的示意图。当闭合开关K时,电极x附近溶液先变红。
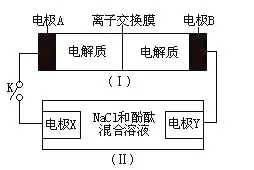
分析:
利用电荷守恒,两个电极方程式分别为:
I3-+2e-=3I-、2S22--2e-=S42-
可以推理出I3-在反应过程中得到2e-。2个S22-在反应过程中失去2e-。
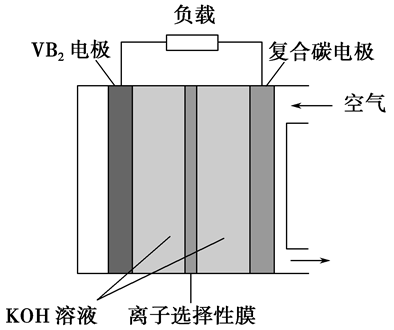
(3)例:一种高性能的碱性硼化钒(VB2)-空气电池如图所示,其中总反应为4VB2+11O2+20OH-+6H2O=8B(OH)4-+4VO43-,写出负极反应。
负极为VB2电极:VB2+16OH--11e-=VO43-+2B(OH)4-+4H2O
根据总反应能判断出VB2的失电子数为11e-,也可以用电极反应的电荷守恒得到VB2的失电子数为11e-。
4、增加电化学反应、化学反应的区分
也称为区分电极反应和电极周围的化学反应。
(1)例:在传统的电解氯化氢回收氯气技术的基础上,科学家最近采用碳基电极材料设计了一种新的工艺方案,主要包括电化学过程和化学过程,如图所示。
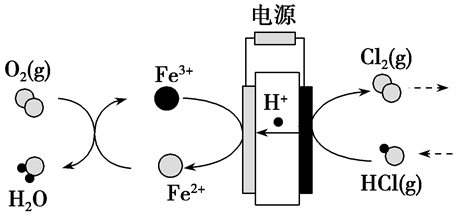
阴极反应为:Fe3++e-=Fe2+
阳极反应为:2HCl-2e-=Cl2+2H+
阴极周围的化学反应为:O2+4H++4Fe2+= 4Fe3++2H2O
(2)例:环戊二烯可用于制备二茂铁(Fe(C5H5)2),二茂铁的电化学制备原理如下图所示,其中电解液为溶解有溴化钠(电解质)和环戊二烯的DMF溶液(DMF为惰性有机溶剂)。
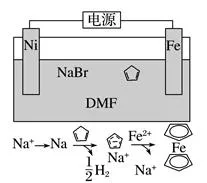
分析:
电解质中无Fe2+,所以阳极为Fe,电极反应为Fe-2e-=Fe2+。
阴极电极反应为Na++e-=Na。
溶液中的化学反应为:
2Na+2C5H6=2C5H5Na+H2↑
2C5H5-+Fe2+= Fe(C5H5)2
5、用纳米材料、多孔材料、纤维材料增加图像复杂度的干扰
这些材料使用的目的是增大反应面积,加快放电、充电、电解的速率。
将反应物放在载体上,并将载体写在反应方程式中。
例:某可充电钴酸锂电池的工作原理如下图所示,该电池放电时,其中一极的电极反应式是LixC6-xe-=xLi++6C,则该极为图中的。
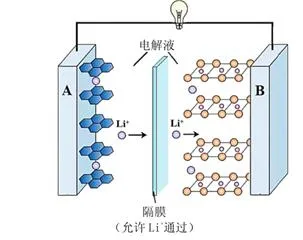
分析:
电极上的复杂图形是指多孔材料。
根据图示,此电池为锂电池,负极为Li金属,C6为Li的载体。
根据Li+的移动方向,a为负极。b为正极,上面附着钴酸锂。
6、增加对工业目的的思考
目的决定反应。
例:H3PO2也可用电渗析法制备。“四室电渗析法”工作原理如图所示(阳膜和阴膜分别只允许阳离子、阴离子通过):
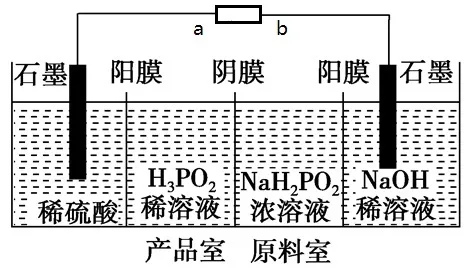
分析:
根据电解目的,原料室中的H2PO2-在电场的作用下进入产品室,稀硫酸中的H+进入产品室,生成H3PO2。推理得a为正极,b为负极。
7、增加有机物分子结构、结构变化的辨认
(1)例:CH4和CO2都是比较稳定的分子,科学家利用电化学装置实现两种分子的耦合转化,其原理如下图所示。
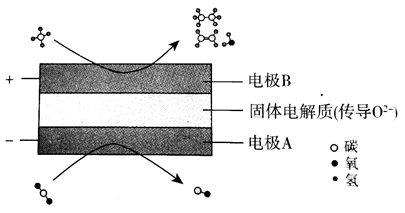
分析:
通过图示辨识,可以看出阳极是CH4转化为CH3CH3或CH2=CH2和H2O,电极反应为:2CH4-2e-+O2-=CH3CH3+H2O或2CH4-4e-+2O2-=CH2=CH2+2H2O
阴极是CO2转化为CO,电极反应为:CO2+2e-=CO+O2-。
(2)一种双电子介体电化学生物传感器,用于检测水体急性生物毒性,其工作原理如图所示。
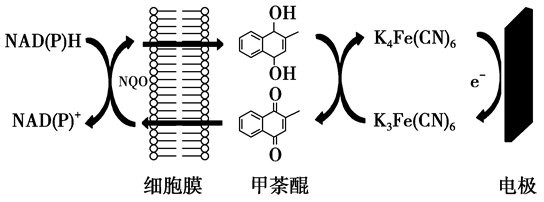
分析:
有机物反应前后的变化是失去了氢,发生了氧化反应。
8、增加不易判断反应物的电化学考查
(1)例:中国科学院深圳研究院成功研发出一种基于二硫化钼/碳纳米复合材料的钠型双离子电池,可充放电,放电时工作原理如图所示。下列说法不正确的是()
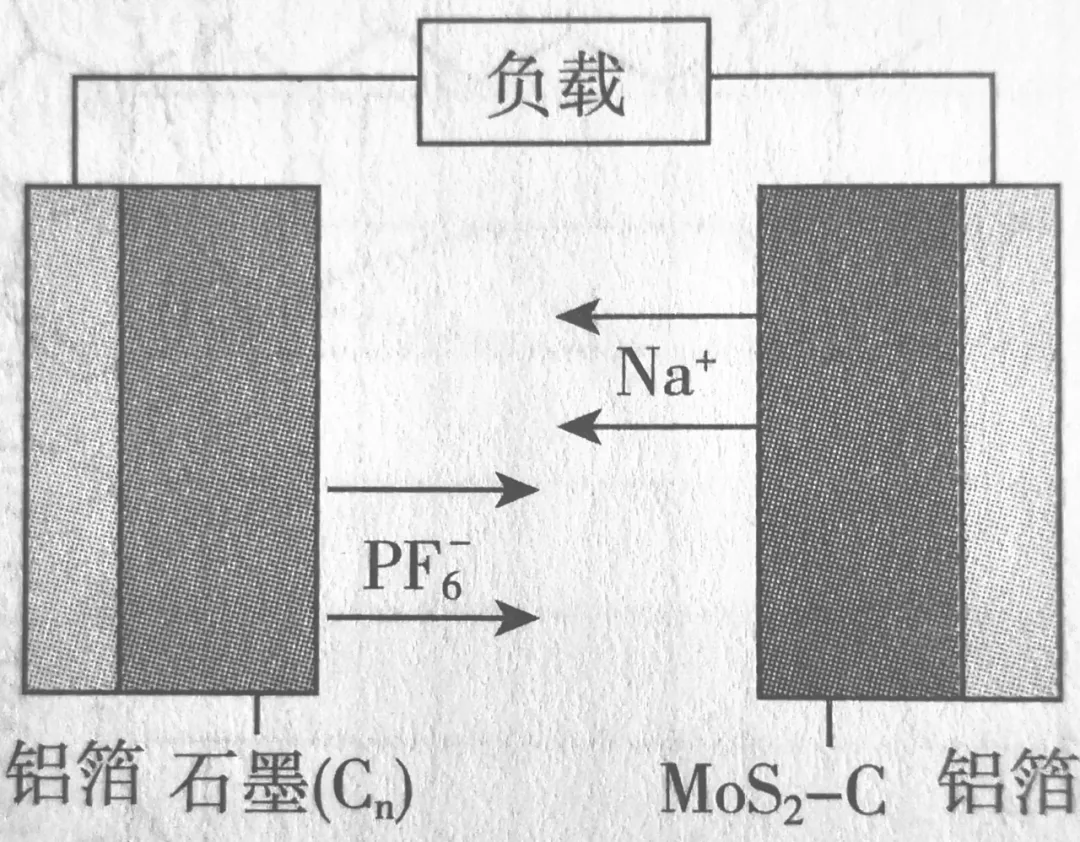
A.二硫化钼/碳纳米复合材料为该电池的负极材料
B.放电时正极的反应式为n(PF6)x+xe-=xPF6-+Cn
C.充电时阴极的电极反应式为MOS2-C+xNa++xe-=NaxMOS2-C
D充电时石墨端铝箔连接外接电源的负极
分析:
此题只有通过题中的选项,才能判断出两个电极的反应。
放电时
负极反应为NaxMOS2-C-xe-=MOS2-C+xNa+
正极反应为n(PF6)x+xe-=xPF6-+Cn
(2)一种浓差电池如图所示,阴、阳离子交换膜交替放置,中间的间隔交替充以河水和海水,选择性透过Na+和Cl-,在两极板形成电势差,进而在外部形成电流。

分析:
根据电子移动方向,b极为负极,a极为正极。Na+向左移动,Cl-向右移动。
负极Cl-发生失电子的反应:2Cl--2e-=Cl2↑。
正极H2O电离出的H+发生得电子的反应:2H++2e-=H2↑。
9、对量的计算分析
(1)利用电子的物质的量计算电极产物的物质的量。
(2)溶液体系内部离子的浓度变化或pH值变化。
(3)膜上穿过的粒子数的计算。
导线中流过的电子数=膜上穿过的离子数╳离子带的电荷数。
然后就可以进行交换膜一侧溶液的浓度、质量的变化计算。
三、综合题
镁稀土合金广泛应用于航空、航天、电子、通讯和汽车制造业等领域。熔盐电解法是一种高效制备镁稀土合金的方法,实验室制取Mg-Gd合金(物质的量比为1∶1)的电解槽示意图如图所示(相对原子质量Mg—24、Gd—157)。下列说法正确的是()
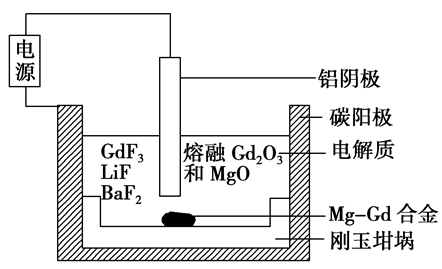
A.添加LiF、BaF2的作用是催化剂
B.阳极的电极反应式为2F--2e-===F2↑
C.当电路中通过0.1 mol 电子时,生成Mg-Gd合金的质量为3.62 g
D.电解结束后,铝、碳电极质量不变
此题需要的电化学知识的能力分析:
先进行基础电化学判断:此装置为电解池,阴极为铝电极,阳极为碳电极。
(1)根据题意知道装置的目的:将熔盐电解为镁稀土合金。
(2)根据目的判断出铝阴极将Mg2+、Gd3+分别电解得到Mg,Gd。
电极反应分别为Mg2++2e-=Mg、Gd3++3e-=Gd。
(3)根据合金存在于铝阴极的底部,判断电解得到的Mg、Gd呈液态,不会附着在铝阴极上,不会造成铝阴极的质量增加。
(4)根据O2-的还原能力大于F-,判断碳阳极上电解O2-得到O2。
(5)根据碳阳极上得到O2和高温环境,判断阳极上会发生C+O2=CO2,阳极的碳会被消耗。
(6)根据电解氧化铝制铝时,需要加入冰晶石,判断加入LiF、BaF2的目的是MgO、Ga2O3在较低的熔点下熔化。
(7)根据导线中电子移动的物质的量等于电极反应得失电子的物质的量,又根据题干中的“Mg-Gd合金(物质的量比为1∶1)”。计算得:
n(Mg)=0.02mol,n(Gd)=0.02mol。质量和为3.62g。
2、(增加辨识困难度的题)我国科学家在天然气脱硫研究方面取得了新进展,利用如图装置可发生反应:H2S+O2===H2O2+S↓。
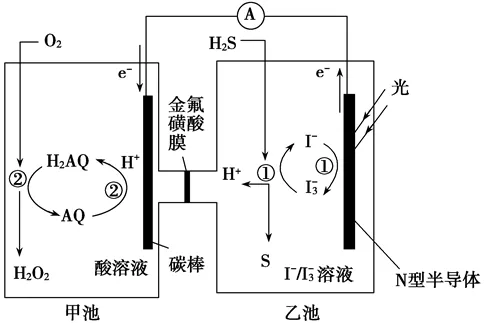
左侧
电极反应为:AQ+2H++2e-=H2AQ
溶液反应为:O2+H2AQ = AQ+H2O2
右侧
电极反应为:3I-+2e-=I3-
溶液反应为:H2S+I3-=3I-+S↓+2H+
【练习】
1、磷酸铁锂电池放电时的反应为LixC6+Li1-xFePO4=6C+LiFePO4。某磷酸铁锂电池的切面如图。下列说法不正确的是( )
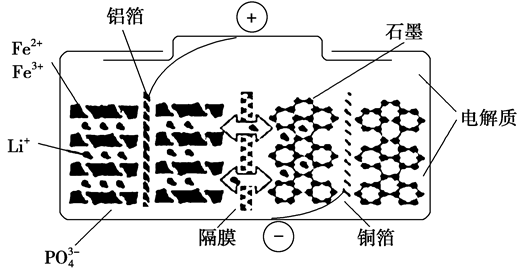
A.放电时,电池负极反应为LixC6-xe-=xLi++6C
B.充电时,阳极上发生的反应为LiFePO4-xe-=Li1-xFePO4+xLi+
C.放电时,Li+脱离石墨,经电解质嵌入负极
D.充电时,电子从电源负极流出经铜箔流入阴极材料
2、电渗析法淡化海水装置示意图如图所示,电解槽中阴离子交换膜和阳离子交换膜相间排列,将电解槽分隔成多个独立的间隔室,海水充满在各个间隔室中。通电后,一个间隔室的海水被淡化,而其相邻间隔室的海水被浓缩,从而实现了淡水和浓缩海水分离。下列说法正确的是()
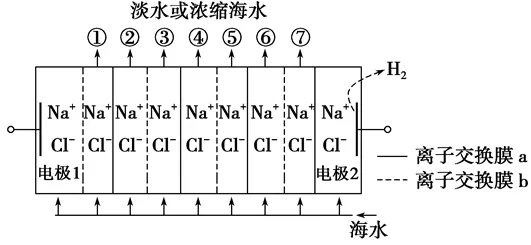
A.离子交换膜b为阳离子交换膜
B.各间隔室的排出液中,①③⑤⑦为淡水
C.通电时,电极1附近溶液的pH比电极2附近溶液的pH变化明显
D.淡化过程中,得到的浓缩海水没有任何使用价值
【练习答案】
1、C
2、B

- 全部评论(0)
