题型攻克一:破解工业流程题的命门——弄懂流程
时间:2021-04-12 16:57 来源:高中化学教学研究 作者:张德金 点击: 次 所属专题: 工艺流程题解题指导
版权申明:凡是署名为“化学自习室”,意味着未能联系到原作者,请原作者看到后与我联系(邮箱:79248376@qq.com)!
一、本题型考查的内容有:
1、氧化还原反应、复分解反应、分解反应的原理与应用。
2、元素化合物的性质及应用。
3、实验中的分离方法:过滤、结晶、蒸馏、萃取、分液、离子交换等。
4、实验中的定性定量分析方法:离子检验、配制溶液、滴定实验等。
5、溶液平衡及移动的应用,如除去Fe3+、Al3+。用某金属化合物除去其它杂质金属离子等。
6、对难溶电解质溶质的理解与Ksp计算。
7、工业生产注意的问题:流程的优化,能量的节省,原料的选择,污染的降低,人力成本,绿色化学等。
二、本题型考查的能力
考查了学生学化学以来形成的综合素养。
1、分析能力,特别是对过量问题和多对象、不同环境下的目标进行很清晰的定位和分析能力。
2、类比、对比、推理、演绎、归纳、创新等逻辑思维方法的运用能力。
3、化学实验能力。
4、简单的计算能力。
5、不同专题的化学知识的综合应用和创新能力。
6、对学生的人文素养中的责任感、节约意识,追求高效率,大型问题的综合规划能力,环境保护意识等能力都有较高要求。
三、本题型最难突破的地方——看懂流程
要采用性质分析+过量分析的思维。
1、怎么看懂一个流程呢?用“3W分析法”:what、how、why。
①用什么去干什么?
②怎么干的?(需要用物质的性质和反应原理去推理、模仿、演绎,灵活应用)
③为什么要这么干?(钻研现象,明白道理,总结经验,积累更多知识,得到提升)
2、示例:用废料,主要成分为MgO、SiO2、Al2O3及少量的Fe2O3、FeO,制备纯净Mg(NO3)2。
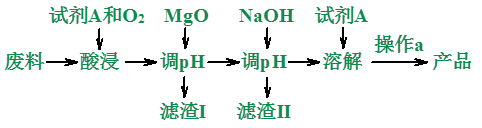
(1)用什么?废料:主要成分为MgO、SiO2、Al2O3及少量的Fe2O3、FeO。
干什么?制备纯净Mg(NO3)2。
(2)怎么干的?这是较难的一个环节,需要学生对常见物质能否进行氧化还原反应的和复分解反应的有较好的把握能力、运用能力和一定的创新能力。
既然要制备Mg(NO3)2,还要用酸浸,那比较容易能推理出试剂a应该是稀HNO3。
①物质的性质分析:
MgO:碱性氧化物,遇强酸会反应。
SiO2:酸性氧化物,遇强碱会反应。
Al2O3:两性氧化物,遇强酸或强碱都反应。
Fe2O3:碱性氧化物,遇强酸会反应。有氧化性,遇强还原剂会发生氧化还原反应。
FeO:碱性氧化物,遇强酸会反应。有还原性,遇强氧化剂会发生氧化还原反应。
稀HNO3:强酸,遇碱性氧化物、碱、弱酸盐都能反应。有强氧化性,与还原剂会发生氧化还原反应。
O2:有氧化性,能发生氧化还原反应。
NaOH:强碱,有强碱性,遇酸性氧化物、酸、弱碱盐都能反应。
②流程分析:
酸浸既发生酸与碱性氧化物的反应,又有对Fe2+的氧化还原反应。MgO消耗HNO3,提高了溶液的pH,促使Fe3+、Al3+水解为氢氧化物沉淀。NaOH使Mg2+生成Mg(OH)2沉淀,然后过滤出Mg(OH)2,再加稀HNO3重新溶解为Mg(NO3)2溶液,最后结晶得Mg(NO3)2。
方程式为:
I、酸浸时:MgO+2HNO3=Mg(NO3)2+H2O
Al2O3+6HNO3=2Al(NO3)3+3H2O
Fe2O3+6HNO3=2Fe(NO3)3+3H2O
4FeO+O2+12HNO3=4Fe(NO3)3+6H2O
过滤后的滤渣I:SiO2。
过滤后的滤液:Mg(NO3)2、2Al(NO3)3、2Fe(NO3)3、HNO3。
II、加MgO时:
MgO+2HNO3=Mg(NO3)2+H2O
Fe(NO3)3+3H2O=Fe(OH)3↓+6HNO3
Al(NO3)3+3H2O=2Al(OH)3↓+6HNO3
滤渣II中有:Fe(OH)3、2Al(OH)3、MgO
过滤后的滤液:Mg(NO3)2、HNO3。
III、加NaOH时:
NaOH+HNO3=NaNO3+H2O
2NaOH+ Mg(NO3)2=Mg(OH)2↓+2NaNO3
IV、加稀HNO3时:
Mg(OH)2+2HNO3=Mg(NO3)2+2H2O
V、操作a为蒸发浓缩,冷却结晶。从Mg(NO3)2溶液中结晶分离得到Mg(NO3)2晶体。
(3)为什么要这么做?
①为什么推理试剂a是稀硝酸,而不是浓硝酸?
浓硝酸挥发能力和分解能力都强,易产生污染气体。
②硝酸有强氧化性,为什么还要通O2?
用O2来氧化Fe2+,避免HNO3氧化Fe2+,产生污染气体。
③为什么第一次调pH用MgO,不用NaOH等?
MgO调pH不用担心引用新杂质,也不用担心pH被调整过度,还无需小心控制量的加入。直接加稍过量的MgO充分搅拌即可。(这对控制人力成本来说,很重要)
④Mg(NO3)2溶液为什么不直接进行浓缩结晶?
将Mg(NO3)2形成Mg(OH)2沉淀,再溶解为Mg(NO3)2,会提高纯度。
⑤操作为什么不是蒸发结晶?
Mg(NO3)2是受热易分解的盐,又是易水解的盐,而且硝酸盐多数都属于易爆炸的盐。蒸发浓缩,冷却结晶更安全,也能防止过度水解,保证得到的是较纯净Mg(NO3)2。
四、工业流程中的分层题型的简略分析
1、简单的题型:
某同学采用硫铁矿焙烧取硫后的烧渣(主要成分为Fe2O3、SiO2、Al2O3,不考虑其他杂质)制取FeSO4•7H2O,设计了如下流程: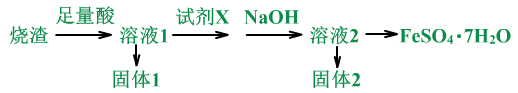
(1)用烧渣:Fe2O3、SiO2、Al2O3来制备FeSO4•7H2O。
(2)怎么干的?
通过产品可以推理,足量酸为稀硫酸。原料中的Fe2O3、Al2O3被稀硫酸溶解,SiO2不反应,为固体1。原料为Fe3+,产品为Fe2+,所以需要加还原剂,试剂x是还原剂,若想不引入新杂质,可加入Fe。NaOH是为了除掉Al3+,固体2为Al(OH)3。
流程中的反应分析:
①足量酸时:Fe2O3+3H2SO4=Fe2(SO4)3+3H2O
Al2O3+3H2SO4=Al2(SO4)3+3H2O
过滤后的滤液:Fe2(SO4)3、Al2(SO4)3、H2SO4。
②加X时:
Fe+Fe2(SO4)3=3Fe2SO4
加NaOH时:
2NaOH+ H2SO4=Na2SO4+2H2O
Al2(SO4)3+6NaOH=2 Al(OH)3↓+ 3Na2SO4
或Al2(SO4)3+6H2O =2 Al(OH)3↓+3H2SO4
过滤后的滤液:Fe2SO4、Na2SO4。
③最后的操作为蒸发浓缩,冷却结晶。
(3)为什么要这么做?
①为什么推理试剂a是稀硫酸,而不是浓硫酸?
浓硫酸一般不用于碱性氧化物的溶解,反应慢,且对设备腐蚀严重,危险程度还大。
②怎么能想到X为Fe?
不引入新的杂质,就决定了不能用其它金属。SO2虽然理论上也可以,但SO2是气体难以运输,在使用时不方便,也没有Fe常见,并且是污染气体,易造成污染。
2、中等的题型:
I、硼氢化钠(NaBH4)在化工等领域具有重要的应用价值,某研究小组采用偏硼酸钠NaBO2为主要原料制备,其流程如下:
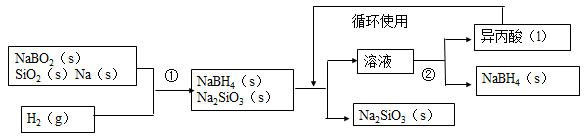
(1)用偏硼酸钠NaBO2来制备硼氢化钠(NaBH4)。
(2)怎么干的?
用NaBO2、SiO2、Na三种固体与H2反应,得到NaBH4、Na2SiO3的固体混合物。将固体混合物放在异丙酸中溶解,NaBH4溶解,Na2SiO3不溶,过滤分离。然后蒸馏得到NaBH4固体和异丙酸液体。异丙酸循环使用。
流程中的反应分析:
①NaBO2+2SiO2+4Na+2H2= NaBH4+2Na2SiO3
(3)为什么要这么做?
①反应中虽然有两个还原剂,但用质量守恒不难配平。
②整个过程并不在水溶液中进行,不要用水溶液中的反应思维来考虑问题。
③异丙酸是溶解NaBh4的溶剂。并且能将NaBH4、Na2SiO3分离。
④此题放在中等题型的原因是反应环境、反应物质、反应原理的新颖。需要学生有较好的灵活性。
II、二氧化铈CeO2是一种重要的稀土氧化物。平板电视显示屏生产过程中产生大量的废玻璃粉末(含SiO2、Fe2O3、CeO2以及其他少量可溶于稀酸的物质)。某课题组以此粉末为原料回收铈,设计实验流程如下:
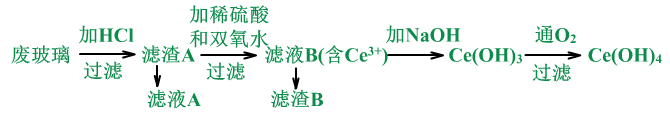
(1)用废玻璃粉末(含SiO2、Fe2O3、CeO2),来制备Ce(OH)4。
(2)怎么干的?
将废玻璃粉末用稀HCl溶解,过滤得滤渣。在滤渣中加稀硫酸、双氧水溶解后,过滤得滤液,此时CeO2生成Ce2(SO4)3。加NaOH溶液沉淀后,通氧气氧化,过滤,得到Ce(OH)4。
流程中的反应分析:
①废玻璃加HCl:Fe2O3+6HCl=3H2O +2FeCl3
滤液A中含FeCl3、HCl和其它可溶性杂质。
滤渣A中含SiO2、CeO2。
②滤渣A加稀硫酸和双氧水:(双氧水起还原剂的作用)
2CeO2+H2O2+3H2SO4= Ce2(SO4)3+4H2O+O2↑
滤液B中含Ce2(SO4)3、H2SO4。
滤渣B中含SiO2。
③滤液B加NaOH
Ce2(SO4)3+6NaOH=2Ce(OH)3↓+ 3Na2SO4
④Ce(OH)3在溶液中与氧气:
4Ce(OH)3+O2+2H2O=4Ce(OH)4
(3)为什么要这么做?
①怎么判断出来CeO2与HCl不反应?
因为滤渣A与稀硫酸双氧水得到了含Ce3+的溶液,所以CeO2没有与HCl反应并且溶解。
②双氧水一般当氧化剂用,为什么在此处当还原剂用,为什么不用别的还原剂?
此处铈的化合价降低,所以双氧水起了还原剂的作用。双氧水当还原剂的好处是不引入新的杂质。
③后面的反应模仿了Fe2+溶液与碱的反应,只要对此知识比较熟练,还是不难的。此题放在中等题型的原因是借用了非常陌生的元素及化合物,考查了对氧化还原反应的理解能力,有一些难度。
3、较难的题型:
I、石墨在材料领域有重要应用,某初级石墨中含SiO2(7.8%)、Al2O3(5.1%)、Fe2O3(3.1%)和MgO(0.5%)等杂质,设计的提纯与综合利用工艺如下:
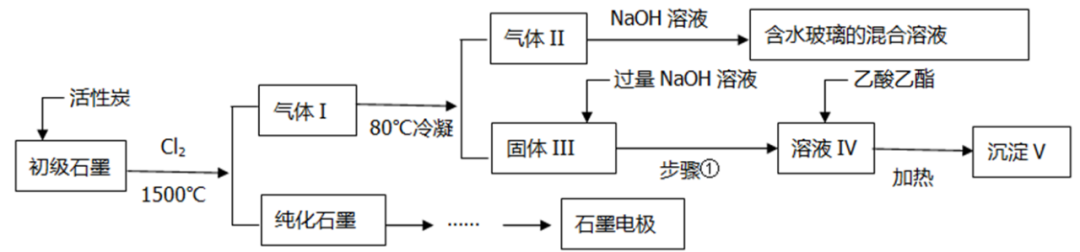
(1)用初级石墨【含SiO2(7.8%)、Al2O3(5.1%)、Fe2O3(3.1%)和MgO(0.5%)等杂质】,来进行分离和综合应用。
(2)怎么干的?
将初级石墨用活性碳、Cl2和高温条件进行纯化,杂质转化为气体1。纯化后的石墨加工成石墨电极。气体降温到80℃后,MgCl2、AlCl3、FeCl3等变为固体,SiCl4、CO2等成为气体II。气体II经过NaOH溶液转化为Na2CO3、NaCl、Na2SiO3。固体用过量NaOH溶液反应,生成NaAlO2溶液和剩余固体。过滤后,用溶液去水解乙酸乙酯,得到Al(OH)3固体。
流程中的反应分析:
①初级石墨与Cl2、活性炭:SiO2+2Cl2+C CO2+SiCl4(g)
CO2+SiCl4(g)
2Al2O3+6Cl2+3C 3CO2+4AlCl3(g)
3CO2+4AlCl3(g)
2Fe2O3+6Cl2+3C 3CO2+4FeCl3(g)
3CO2+4FeCl3(g)
2MgO+2Cl2+C CO2+2MgCl2(g)
CO2+2MgCl2(g)
②气体II与NaOH溶液
CO2+2NaOH=Na2CO3+H2O
SiCl4+6NaOH=Na2SiO3+4NaCl+3H2O
③固体III与过量NaOH溶液
AlCl3+4NaOH=NaAlO2+3NaCl+2H2O
④溶液IV与乙酸乙酯:
NaAlO2+CH3COOCH2CH3+2H2O Al(OH)3↓+CH3COONa +CH3CH2OH
Al(OH)3↓+CH3COONa +CH3CH2OH
NaOH+CH3COOCH2CH3 CH3COONa +CH3CH2OH
CH3COONa +CH3CH2OH
(3)为什么要这么做?
①为什么采用高温和氯气?为什么还要加活性炭?
初始石墨的纯化利用了石墨的熔点特别高,而金属和非金属的氯化物的沸点相对较低,采用高温形成气态氯化物对杂质进行分离。
但氯气并不能置换氧化物中的氧。加活性炭是为了用碳将氧化物中的氧转化为CO2,以利于氧化物转化为氯化物。
②80℃冷凝的目的是什么?
为了将金属氯化物与SiCl4进行分离。
③为什么用乙酸乙酯将NaAlO2转化为Al(OH)3?
转化后的溶液经过酸化处理后,还可以转化为乙酸乙酯,重新循环利用。
④此题放在中等题型的原因是起始点的反应原理不容易理解,80℃冷凝的目的也不太容易判断,乙酸乙酯的反应也很新颖。
II、Li4Ti5O12和LiFePO4都是锂离子电池的电极材料,可利用钛铁矿(主要成分为FeTiO3,还含有少量MgO、SiO2等杂质)来制备,工艺流程如下:
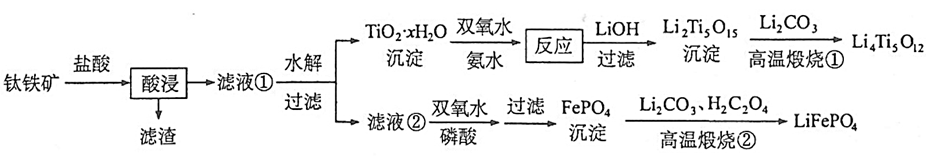
(1)用钛铁矿(FeTiO3,含少量MgO、SiO2),来制备Li4Ti5O12和LiFePO4。
(2)怎么干的?
将钛铁矿用盐酸溶解,生成FeCl2、TiCl4,SiO2不溶于盐酸,过滤成为滤渣。滤液①水解TiCl4并过滤得到TiO2•xH2O。
TiO2•xH2O与氨水、双氧水(氧化性)反应,得到(NH4)2Ti5O15溶液。(NH4)2Ti5O15溶液与LiOH反应得到Li2Ti5O15沉淀。Li2Ti5O15沉淀与Li2CO3一起煅烧得到Li4Ti5O12。
滤液②与双氧水(氧化性)、磷酸反应得到FePO4。FePO4与Li2CO3、H2C2O4(还原性)反应得到LiFePO4。
流程中的反应分析:
①钛铁矿与盐酸反应:
FeTiO3+6HCl =FeCl2+TiCl4+3H2O
MgO+2HCl =MgCl2+H2O
滤渣为SiO2等。
滤液中有FeCl2、TiCl4、MgCl2、HCl。
②滤液①水解:
TiCl4+(x+2)H2O= TiO2•xH2O+4HCl
滤渣为TiO2•xH2O。
滤液②中有FeCl2、MgCl2、HCl。
③TiO2•xH2O与双氧水、氨水反应:
5TiO2•xH2O+4H2O2+2NH3•H2O=(NH4)2Ti5O15+(5x+5)H2O
④溶液与反应:
(NH4)2Ti5O15+2L iOH=Li2Ti5O15↓+2NH3•H2O
⑤Li2Ti5O15与Li2CO3高温反应:
Li2Ti5O15+Li2CO3 L i4Ti5O12+CO2↑+2O2↑。
L i4Ti5O12+CO2↑+2O2↑。
⑥滤液②与双氧水、磷酸反应:
2FeCl2+H2O2+2H3PO4=2FePO4↓+4HCl+2H2O
⑦FePO4与Li2CO3、H2C2O4反应:
2FePO4+Li2CO3+H2C2O4 2L iFePO4+H2O+3CO2↑
2L iFePO4+H2O+3CO2↑
(3)为什么要这么做?
本问题的难度在于设计了四个氧化还原反应,借助的物质陌生、复杂,且有的反应得失电子数不易判断。需要有非常熟练的氧化还原反应方程式的书写能力。
4、更难的题型:
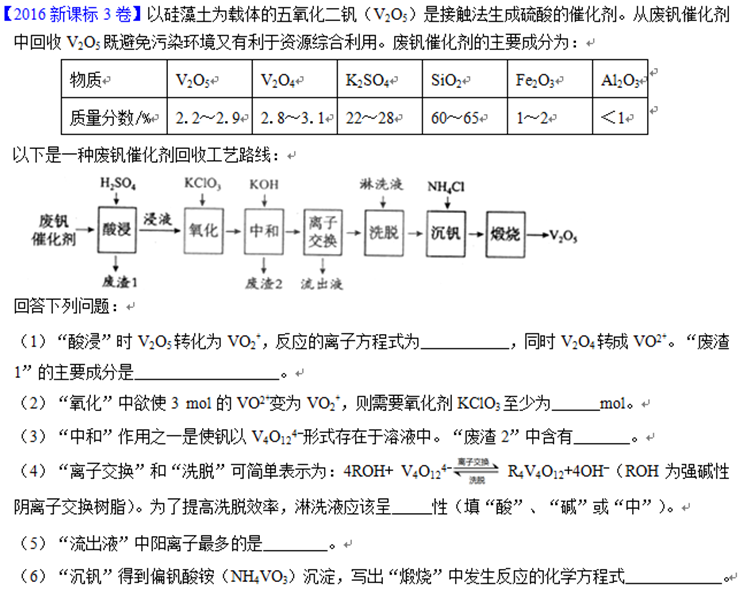
(1)用废钒催化剂:含V2O5、V2O4、K2SO4、SiO2、Fe2O3、Al2O3来制备V2O5。
(2)怎么干的?(需要看下面出的问题才能推理)
废钒催化剂通过稀硫酸酸浸,将V2O5转化为(VO2)2SO4,V2O4转化为VOSO4,Fe2O3转化为Fe2(SO4)3,Al2O3转化为Al2(SO4)3。过滤得滤渣SiO2。
然后用KClO3将滤液中的VOSO4氧化为(VO2)2SO4。
用KOH有两个功能,一是将Fe2(SO4)3和Al2(SO4)3转化为氢氧化物沉淀而除去,二是将(VO2)2SO4转化为K4V4O12。
K4V4O12通过离子交换和洗脱,得到净化。然后加入NH4Cl,生成NH4VO3沉淀。过滤后,将NH4VO3加热分解得V2O5。
流程中的反应分析:
①稀硫酸酸浸时:
V2O5+H2SO4=(VO2)2SO4+H2O
V2O4+2H2SO4=2VOSO4+2H2O
Fe2O3+3H2SO4=Fe2(SO4)3+3H2O
Al2O3+3H2SO4=Al2(SO4)3+3H2O
滤渣1为SiO2。
滤液中有(VO2)2SO4、VOSO4、Fe2(SO4)3、Al2(SO4)3、H2SO4、K2SO4。
②加KClO3时:
6VOSO4+KClO3+3H2O=3(VO2)2SO4+KCl+3H2SO4
③加KOH时:
2(VO2)2SO4+8KOH=K4V4O12+2K2SO4+4H2O
Fe2(SO4)3+6KOH=2Fe(OH)3↓+3K2SO4
Al2(SO4)3+6KOH=2Al(OH)3↓+3K2SO4
废渣2为Fe(OH)3、Al(OH)3。
滤液中有K4V4O12、K2SO4。
④K4V4O12通过离子交换和洗脱,得到净化。
流出液中主要是KOH、K2SO4。
淋洗液应该是高浓度的KOH。
⑤沉矾时:
4NH4Cl+ K4V4O12=4NH4VO3↓+4KCl
NH4Cl+ KOH=NH3•H2O+KCl
⑥煅烧时:
2NH4VO3 V2O5+2NH3↑+H2O
V2O5+2NH3↑+H2O
(3)为什么要这么做?
本题的难度之一是只看流程是看不懂的,需要结合下面的问题才能看懂流程。难度之二是,物质陌生,产物的离子难写,化合物也难写。难度之三是有较难书写的复分解反应和氧化还原反应方程式。难度之四是对于离子的交换和反交换,可能会不熟练。
【练习】
写出每个流程所有环节的化学反应,并指出滤液和滤渣的成分。
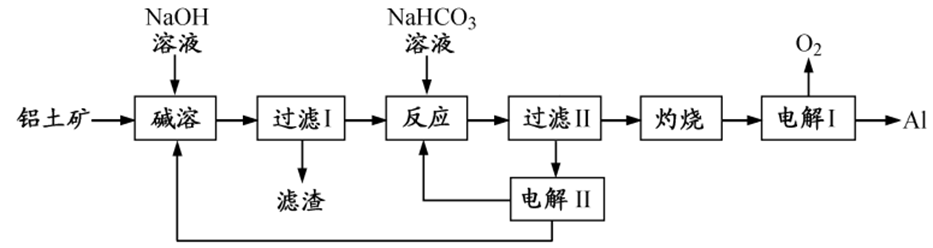
1、铝是应用广泛的金属。以铝土矿(主要成分为Al2O3,含SiO2和Fe2O3等杂质)为原料制备铝的一种工艺流程如下:
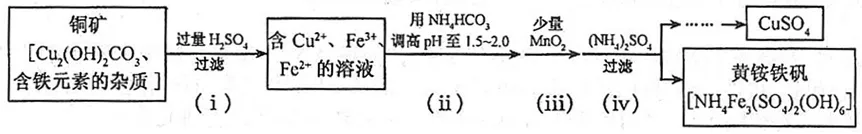
2、酸浸法制取硫酸铜的流程示意图如下
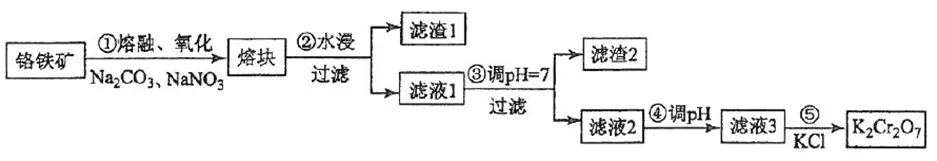
3、重铬酸钾是一种重要的化工原料,一般由铬铁矿制备,铬铁矿的主要成分为FeO·Cr2O3,还含有硅、铝等杂质。制备流程如图所示:
【练习答案】
1、①碱溶:Al2O3+2NaOH=2NaAlO2+H2O
过滤I的滤渣为SiO2、Fe2O3等杂质。
滤液为NaAlO2。
②加NaHCO3时:
NaHCO3+NaAlO2+H2O= Na2CO3+Al(OH)3↓
过滤II的滤渣为Al(OH)3。
滤液为Na2CO3。
③电解II时:
Na2CO3+H2O NaHCO3+NaOH
NaHCO3+NaOH
④灼烧时:
2Al(OH)3 Al2O3+3H2O
Al2O3+3H2O
⑤电解I时:
2Al2O3(熔融)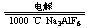 4Al+3O2↑
4Al+3O2↑
2、①过量H2SO4时:
Cu2(OH)2CO3+2H2SO4=2CuSO4+CO2↑+3H2O
还有关于铁元素的反应。
②用NH4HCO3调pH:
2NH4HCO3+H2SO4=(NH4)2SO4+2CO2↑+2H2O
③加MnO2时:
MnO2+2FeSO4+2H2SO4=MnSO4+Fe2(SO4)3+2H2O
④加(NH4)2SO4时:
(NH4)2SO4+3Fe2(SO4)3+12H2O=2NH4Fe3(SO4)2(OH)6↓+6H2SO4
3、①Na2CO3+SiO2 Na2SiO3+CO2↑
Na2SiO3+CO2↑
Na2CO3+Al2O3 2NaAlO2+CO2↑
2NaAlO2+CO2↑
10FeO·Cr2O3+13Na2CO3+14NaNO3 5Fe2O3+20Na2CrO4+7N2↑+13CO2↑
5Fe2O3+20Na2CrO4+7N2↑+13CO2↑
(假设生成无污染气体)
②水浸、过滤:
滤渣为Fe2O3。
滤液为Na2CrO4、NaAlO2、Na2SiO3和可能剩余的Na2CO3。
③调pH=7:(可能加的是稀硫酸)
2NaAlO2+2H2O+H2SO4= 2Al(OH)3↓+Na2SO4
Na2SiO3+H2SO4= H2SiO3↓+Na2SO4
Na2CO3+H2SO4=Na2SO4+CO2↑+H2O
滤渣为Al(OH)3、H2SiO3。
滤液为Na2CrO4和可能剩余的Na2SO4。
④调pH:(继续加稀硫酸)
2Na2CrO4+H2SO4=Na2Cr2O7+H2O
⑤加KCl:
Na2Cr2O7+2KCl=K2Cr2O7↓+2NaCl

- 全部评论(0)
