难点八:溶液中的三大守恒和离子浓度比较
时间:2021-04-15 11:00 来源:高中化学教学研究 作者:张德金 点击: 次 所属专题: 三大守恒
版权申明:凡是署名为“化学自习室”,意味着未能联系到原作者,请原作者看到后与我联系(邮箱:79248376@qq.com)!
要学会三大守恒,先要明白三大守恒的含义,再学会分析各溶液平衡体系中粒子种类、相互关系的方法,最后解决守恒式的书写和粒子的浓度大小排列顺序。
三大守恒定律有物料守恒、质子守恒和电荷守恒。
1、三大守恒的含义
以NaCl溶液的三大守恒为例,明白什么是三大守恒。
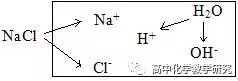
上面图示的含义是,方框表示水溶液体系。右上角的H2O表示的是溶剂H2O的电离。方框外的物质是溶解前的溶质。左侧方框内的是溶质溶解产生的离子、分子及演化过程。
(1)电荷守恒:是指任何电解质溶液中所有阳离子所带正电荷总数与所有阴离子所带负电荷总数相同的。
c(Na+)+c(H+)= c(Cl-)+ c(OH-)
实际应该写成物质的量乘以电荷数加和相等。在同一溶液中,粒子面对的溶液体积相等,浓度与物质的量成正比,所以用浓度代表了物质的量。浓度具有更广泛的实用性。
(提醒:离子带几个电荷,浓度前面的倍数就是几)
(2)物料守恒:是指除了溶剂对应的H+、OH-、H2O之外,其它的由溶质产生的粒子(离子或分子)的数量守恒关系。与原子守恒类似。
c(Na+)=c(Cl-)
含义是溶质NaCl电离出的Na+与Cl-数目相等。
(3)质子守恒:是指表示H+与OH-的来源与去向的守恒。(又叫H+守恒,或OH-守恒)
c(H+)= c(OH-)
含义是溶液中电离出H+和OH-的只有溶剂水,水电离出的H+和OH-数目相等。
(4)粒子的浓度大小排列顺序:(H2O除外,默认为溶质的量比较多)
c(Na+)= c(Cl-)>c(H+)=c(OH-)。
2、用图示分析法来解决三大守恒和浓度大小比较
(1)Na2SO4溶液的电离分析:
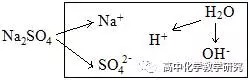
电荷守恒:c(Na+)+c(H+)=2c(SO42-)+c(OH-)
物料守恒:c(Na+)=2c(SO42-)
质子守恒:c(H+)=c(OH-)
粒子的浓度大小排列顺序:c(Na+)=2c(SO42-)>c(OH-)=c(H+)
或c(Na+)>c(SO42-)>c(OH-)=c(H+)
(2)NaOH溶液的电离分析:
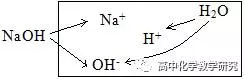
电荷守恒:c(Na+)+c(H+)=c(OH-),这个等式也是质子守恒式(本溶液考虑是的OH-的来源,NaOH电离出的OH-加上H2O电离出的OH-等于总的OH-)
粒子的浓度大小排列顺序:c(OH-)>c(Na+)>c(H+)
(3)CH3COOH溶液的电离分析:
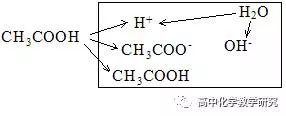
电荷守恒:c(H+)=c(CH3COO-)+c(OH-),这个等式也是质子守恒式(本溶液考虑是的H+的来源,CH3COOH电离出的H+加上H2O电离出的H+等于总的H+)
粒子的浓度大小排列顺序:c(CH3COOH)>c(H+)> c(CH3COO-)> c(OH-)。
这是因为CH3COOH是弱电解质,电离变为CH3COO-和H+的较少,剩余的CH3COOH较多。
(4)CH3COONa溶液的水解分析:
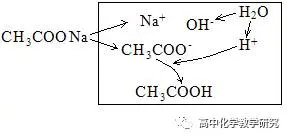
电荷守恒:c(Na+)+c(H+)=c(CH3COO-) + c(OH-)
物料守恒:c(Na+)=c(CH3COO-)+c(CH3COOH) [c(CH3COO-)是水解后剩余的CH3COO-浓度]
质子守恒:c(OH-)=c(H+)+ c(CH3COOH)(水电离出来的总的OH-等于总的H+等于剩余的H+加上被水解结合掉的H+)
粒子的浓度大小排列顺序:c(Na+)>c(CH3COO-)> c(OH-)>c(CH3COOH )>c(H+)。
CH3COO-的水解掉的量很少,生成的CH3COOH也很少,剩余的CH3COO-较多。
(5)Na2CO3溶液的两种水解分析。(比用连续水解的方式分析起来容易)
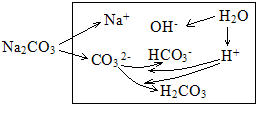
电荷守恒:c(Na+)+c(H+)=2c(CO32-)+c(HCO3-)+c(OH-)
物料守恒:c(Na+)=2[c(CO32-)+c(HCO3-)+c(H2CO3)]
质子守恒:c(OH-)=c(H+)+ c(HCO3-)+2c(H2CO3) [c(H2CO3)的前面有2,是因为CO32-水解为H2CO3需要结合2H+]
粒子的浓度大小排列顺序:c(Na+)>c(CO32-)> c(OH-)> c(HCO3-)>c(H2CO3)>c(H+)。
CO32-的水解掉的量很少,生成的HCO3-和H2CO3也很少,剩余的CO32-较多,而CO32-的一级水解程度比二级水解程度大,产生的HCO3-比H2CO3多。
(6)NaHCO3溶液中的HCO3-既有电离又有水解分析。
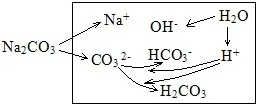
电荷守恒:c(Na+)+c(H+)=2c(CO32-)+c(HCO3-)+c(OH-)
物料守恒:c(Na+)=c(CO32-)+c(HCO3-)+c(H2CO3)
质子守恒:c(H+)+c(H2CO3)= c(OH-) +c(CO32-)(此式可以理解为:剩余的H++水解结合掉的H+=水电离出的H++HCO3-电离出的H+)
粒子的浓度大小排列顺序:c(Na+)> c(HCO3-)> c(OH-)> c(H2CO3)>c(H+)> c(CO32-)。
上面的排列顺序是很多练习册中给出的答案,理由是NAHCO3溶液显碱性,HCO3-的水解大于电离,生成的H2CO3比CO32-多。但这个排列顺序有争议,原因是溶液中可能存在2HCO3-⇌H2CO3+CO32-,可能导致c(H2CO3)、c(CO32-)比c(OH-)、c(H+)大。
3、CH3COOH与CH3COONa等量混合液(显酸性)的三大守恒和粒子的浓度大小排列顺序。
(1)此问题中CH3COOH的电离与CH3COO-的水解是一对矛盾。矛盾只能确定一种可能。
(2)溶液显酸性,说明只有CH3COOH的电离,没有CH3COO-的水解。
(3)用图示法分析溶液的变化。
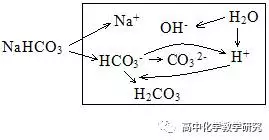
(4)三大守恒和粒子的浓度大小排列顺序
电荷守恒:c(Na+)+c(H+)=c(CH3COO-) + c(OH-)
物料守恒:2c(Na+)=c(CH3COO-)+ c(CH3COOH)
质子守恒:c(H+)-c(OH-)= c(CH3COO-)-c(Na+)=c(Na+)- c(CH3COOH)= [c(CH3COO-)- c(CH3COOH)]/2
粒子的浓度大小排列顺序:c(CH3COO-)>c(Na+)>c(CH3COOH) >c(H+)>c(OH-)
【练习】
写出写出下列溶液的三大守恒关系式和粒子排列顺序
(1)BaCl2溶液。
(2)HNO3溶液。
(3)MgCl2溶液。
(4)Na2SO3溶液。
(5)NaHSO3溶液(酸性)。
(6)NH4Cl与NH3•H2O等量的混合溶液(显碱性)
(7)挑战:(NH4)2CO3溶液(碱性)
【练习答案】
(1)电荷守恒:
2c(Ba2+)+c(H+)=c(Cl-)+c(OH-)
物料守恒:2c(Ba2+)= c(Cl-)
质子守恒:c(OH-)= c(H+)
粒子的浓度大小排列顺序:
2c(Ba2+)= c(Cl-)>c(OH-)=c(H+)
或c(Cl-) >c(Ba2+)>c(OH-)=c(H+)
(2)电荷守恒或质子守恒:
c(H+)=c(NO3-)+ c(OH-)
粒子的浓度大小排列顺序:
c(H+) > c(NO3-) > c(OH-)
(3)电荷守恒:
2c(Mg2+)+c(H+)=c(Cl-) + c(OH-)
物料守恒:
2c(Mg2+)+ 2c[Mg (OH)2]= c(Cl-)
质子守恒:
c(H+) = c(OH-)+ 2c[Mg (OH)2]
粒子的浓度大小排列顺序:
c(Cl-) > c(Mg2+)> c(H+)> c[Mg(OH)2] > c(OH-)。
(4)电荷守恒:
c(Na+)+c(H+)=2c(SO32-)+c(HSO3-)+c(OH-)
物料守恒:
c(Na+)=2[c(SO32-) +c(HSO3-)+c(H2SO3)]
质子守恒:
c(OH-)= c(H+)+ c(HSO3-)+2c(H2SO3)
粒子的浓度大小排列顺序:
c(Na+)> c(SO32-)> c(OH-)>c(HSO3-)>c(H2SO3) >c(H+)。
(5)电荷守恒:
c(Na+)+c(H+)=2c(SO32-)+c(HSO3-)+c(OH-)
物料守恒:
c(Na+)=c(SO32-) +c(HSO3-)+c(H2SO3)
质子守恒:
c(H+)+c(H2SO3) = c(OH-)+c(SO32-)
粒子的浓度大小排列顺序:
c(Na+) > c(HSO3-)>c(H+)>c(SO32-)> c(OH-)> c(H2SO3)。
(6)电荷守恒:
c(NH4+)+c(H+)=c(Cl-) + c(OH-)
物料守恒:
2c(Cl-) = c(NH4+)+c(NH3•H2O)
质子守恒:
c(OH-)-c(H+)= c(Cl-)- c(NH3•H2O)= c(NH4+)-c(Cl-)=[c(NH4+)-c(NH3•H2O)]/2
粒子的浓度大小排列顺序:
c(NH4+)>c(Cl-)> c(NH3•H2O) >c(OH-)>c(H+)
(7)电荷守恒:
c(NH4+)+c(H+)=2c(CO32-)+c(HCO3-)+c(OH-)
物料守恒:
c(NH4+) + c(NH3•H2O)=2[c(CO32-)+c(HCO3-)+c(H2CO3)]
质子守恒:
c(H+)+ c(HCO3-)+2c(H2CO3)= c(OH-) +c(NH3•H2O)
粒子的浓度大小排列顺序:需要平衡常数才能写。

- 全部评论(0)
