第十三讲:水溶液中的平衡体系(二)溶液平衡体系中的几个难点
时间:2021-04-19 16:11 来源:未知 作者:张德金 点击: 次 所属专题: 离子浓度大小比较 三大守恒
版权申明:凡是署名为“化学自习室”,意味着未能联系到原作者,请原作者看到后与我联系(邮箱:79248376@qq.com)!
一、水溶液中的平衡问题为什么难度更大
与气体(可能含固体)的化学平衡相比,水溶液中的平衡体系的粒子种类较多,平衡较多,有时对象给得不清晰,各平衡之间有联系,计算相对复杂,所以在思考和分析时难度就更大一些。
例如,化学平衡中的N2+3H2⇌2NH3,分析对象只有三个,都在方程式中写着。
而在很简单的CH3COOH溶液平衡体系中,表面上只看到了CH3COOH,实际上分析对象有四个:CH3COOH、CH3COO-、H+、OH-、H2O。而平衡体系就有两个,CH3COOH⇌CH3COO-+H+,H2O⇌H++OH-。这两个平衡体系相互还有影响。
而Na2CO3溶液平衡体系中的分析对象有七个:Na+、CO32-、HCO3-、H2CO3、H+、OH-、H2O。平衡体系有三个,H2O⇌H++OH-,CO32-+H+⇌HCO3-,HCO3-+ H+⇌H2CO3。
二、溶液平衡体系中的三大守恒和浓度大小比较的解决方法
要学会三大守恒,先要明白三大守恒的含义,再学会分析各溶液平衡体系中粒子种类、相互关系的方法,最后解决守恒式的书写和粒子的浓度大小排列顺序。
盐类水解中的三大守恒定律有物料守恒、质子守恒和电荷守恒。
1、三大守恒的含义
以NaCl溶液的三大守恒为例,明白什么是三大守恒。
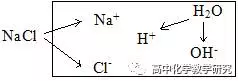
(1)电荷守恒:是指任何电解质溶液中所有阳离子所带正电荷总数与所有阴离子所带负电荷总数相同的。
c(Na+)+c(H+)= c(Cl-)+ c(OH-)
(提醒:离子带几个电荷,其倍数就是几)
(2)物料守恒:是指除了H+、OH-、H2O之外,其它的由溶质产生的粒子(离子或分子)守恒,又叫原子守恒。
c(Na+)=c(Cl-)
(3)质子守恒:是指表示H+与OH-的关系,包括它们的来源与去向的守恒。(又叫H+守恒,或OH-守恒)
c(H+)=c(OH-)
(4)粒子的浓度大小排列顺序(H2O除外,默认为溶质的量比较多)
利用三大守恒分析得:c(Na+)= c(Cl-)>c(H+)=c(OH-)。
2、用图示分析法来解决三大守恒和浓度大小比较
(1)Na2SO4溶液的电离分析:
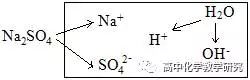
电荷守恒:c(Na+)+c(H+)=2c(SO42-)+c(OH-)
物料守恒:c(Na+)=2c(SO42-)
质子守恒:c(H+)=c(OH-)
粒子的浓度大小排列顺序:c(Na+)=2c(SO42-)>c(OH-)=c(H+)
或c(Na+)>c(SO42-)>c(OH-)=c(H+)
(2)NaOH溶液的电离分析:
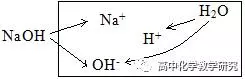
电荷守恒:c(Na+)+ c(H+)=c(OH-),这个等式也是质子守恒式(本溶液考虑是的OH-的来源,NaOH电离出的OH-加上H2O电离出的OH-等于总的OH-)
粒子的浓度大小排列顺序:c(OH-)>c(Na+)> c(H+)
(3)CH3COOH溶液的电离分析:
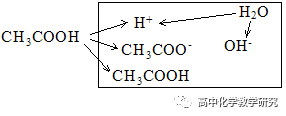
电荷守恒:c(H+)=c(CH3COO-)+ c(OH-),这个等式也是质子守恒式(本溶液考虑是的H+的来源,CH3COOH电离出的H+加上H2O电离出的H+等于总的H+)
粒子的浓度大小排列顺序:c(CH3COOH) >c(H+)> c(CH3COO-)>c(OH-)。
这是因为CH3COOH是弱电解质,电离变为CH3COO-)和H+的较少,剩余的CH3COOH较多。
(4)CH3COONa溶液的水解分析:
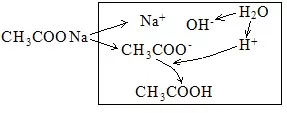
电荷守恒:c(Na+)+C(H+)=c(CH3COO-) + c(OH-)
物料守恒:c(Na+)=c(CH3COO-)+ c(CH3COOH)[c(CH3COO-)是水解后剩余的CH3COO-浓度]
质子守恒:c(OH-)= c(H+)+ c(CH3COOH)(水电离出来的总的OH-等于总的H+等于剩余的H+加上被水解结合掉的H+)
粒子的浓度大小排列顺序:c(Na+)> c(CH3COO-)>c(OH-)>c(CH3COOH) >c(H+)。
CH3COO-的水解掉的量很少,生成的CH3COOH也很少,剩余的CH3COO-较多。
(5)Na2CO3溶液的两种水解分析。(比用连续水解的方式分析起来容易)
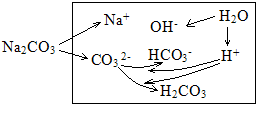
电荷守恒:c(Na+)+c(H+)=2c(CO32-)+c(HCO3-)+c(OH-)
物料守恒:c(Na+)=2[c(CO32-) +c(HCO3-)+c(H2CO3)]
质子守恒:c(OH-)= c(H+)+ c(HCO3-)+2c(H2CO3) [c(H2CO3)的前面有2,是因为CO32-水解为H2CO3需要结合2H+]
粒子的浓度大小排列顺序:c(Na+)> c(CO32-)> c(OH-)>c(HCO3-)>c(H2CO3) >c(H+)。
CO32-的水解掉的量很少,生成的HCO3-和H2CO3也很少,剩余的CO32-较多,而CO32-的一级水解程度比二级水解程度大,产生的HCO3-比H2CO3多。
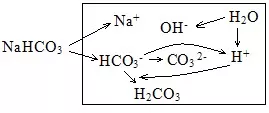
(6)NaHCO3溶液中的HCO3-既有电离又有水解分析。
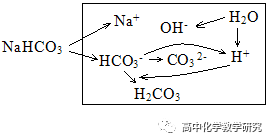
电荷守恒:c(Na+)+c(H+)=2C(CO32-)+c(HCO3-)+c(OH-)
物料守恒:c(Na+)=c(CO32-) +c(HCO3-)+c(H2CO3)
质子守恒:c(H+)+c(H2CO3) = c(OH-)+c(CO32-) (此式可以理解为:剩余的H++水解结合掉的H+=水电离出的H++HCO3-电离出的H+)
粒子的浓度大小排列顺序:c(Na+) > c(HCO3-)>c(OH-)> c(H2CO3) >c(H+)> c(CO32-)。
上面的排列顺序是很多练习册中给出的答案,理由是NaHCO3溶液显碱性,HCO3-的水解大于电离,生成的H2CO3比CO32-多。但这个排列顺序有争议,原因是溶液中可能存在2HCO3-⇌H2CO3+CO32-,可能导致c(H2CO3)、C(CO32-)比c(OH-)、c(H+)大。
3、CH3COOH与CH3COONa等量混合液(显酸性)的三大守恒和粒子的浓度大小排列顺序。
(1)此题中CH3COOH的电离与CH3COO-的水解是一对矛盾。
(2)溶液显酸性,说明只有CH3COOH的电离,没有CH3COO-的水解。
(3)用图示法分析溶液的变化。
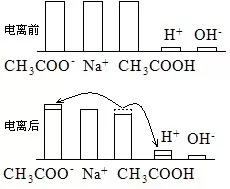
(4)三大守恒和粒子的浓度大小排列顺序
电荷守恒:c(Na+)+c(H+)=c(CH3COO-) + c(OH-)
物料守恒:2c(Na+)=c(CH3COO-)+ c(CH3COOH)
质子守恒:c(H+)-c(OH-)= c(CH3COO-)-c(Na+)=c(Na+)- c(CH3COOH)= [c(CH3COO-)- c(CH3COOH)]/2
粒子的浓度大小排列顺序:c(CH3COO-)>c(Na+)>c(CH3COOH) >c(H+)>c(OH-)
三、溶液平衡体系中一种重要的选择题型
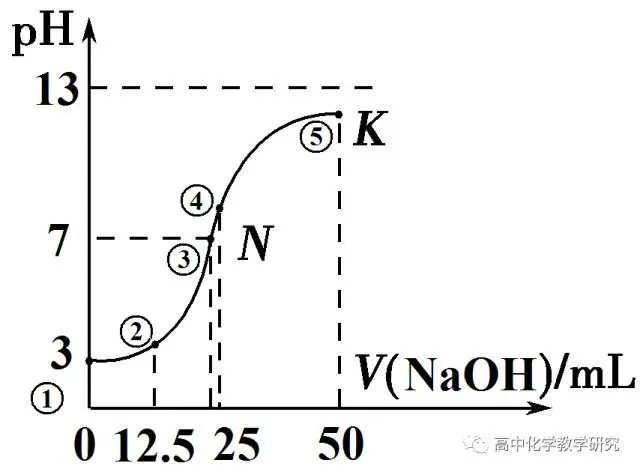
1、常温下,向25 mL 0.1mol·L-1CH3COOH溶液中逐滴加入0.1mol·L-1NaOH溶液,图中所示曲线表示混合溶液的pH变化情况。
此题可以考查三大守恒和粒子的浓度大小排列顺序,及其它一些特殊的问题。
(1)在此题的分析中,除了①点之外,存在一个共同的电荷守恒,c(Na+)+c(H+)=c(OH-)+c(CH3COO-)。
(2)此题经常以选择题的形式对五个点进行考查。
①可以考查醋酸的电离平衡常数:根据c(CH3COO-)≈c(H+)=1×10-3mol/L 求得Ka=1×10-5。
也可以考查电荷守恒或质子守恒:c(H+)=c(CH3COO-)+c(OH-)。
或粒子的浓度大小排列顺序:c(CH3COOH) >c(H+)> c(CH3COO-)>c(OH-)。
②此时溶液中CH3COONa与CH3COOH的物质的量相等。
物料守恒:c(CH3COO-) +c(CH3COOH)=2c(Na+)
质子守恒:c(H+)-c(OH-)= c(CH3COO-)-c(Na+)
c(Na+)-c(CH3COOH)= [c(CH3COO-)- c(CH3COOH)]/2
粒子的浓度大小排列顺序:c(CH3COO-)>C(Na+)>C(CH3COOH) >c(H+)>C(OH-)
③此时溶液中pH=7,粒子的浓度大小排列顺序:
c(CH3COO-)=c(Na+)> c(CH3COOH) >c(H+)=c(OH-)
质子守恒:c(H+)=c(OH-)
物料守恒:无。c(CH3COO-)+ c(CH3COOH)>c(Na+)
④此时溶液中恰好反应,溶质为CH3COONa。
物料守恒:c(CH3COO-) +c(CH3COOH)=c(Na+)
质子守恒:c(OH-)= c(H+)+ c(CH3COOH)
粒子浓度排列:
c(Na+)>c(CH3COO-)>c(OH-)>c(CH3COOH) >c(H+)
⑤此时溶液中CH3COONa与NaOH的物质的量相等。
物料守恒:2[c(CH3COO-) +c(CH3COOH)]=c(Na+)
质子守恒为
c(OH-)-c(H+)= 0.5c(Na+) +c(CH3COOH)
粒子浓度排列为
c(Na+)>c(OH-)>c(CH3COO-)>c(CH3COOH) >c(H+)
(3)除了上述五个可能之外,还有时会考查其它的离子排列顺序可能,一共有11种:
c(H+)>c(CH3COO-)>c(OH-)
c(H+)>c(CH3COO-)>c(OH-)>c(Na+)
c(H+)=c(CH3COO-)>c(OH-)=c(Na+)
c(CH3COO-)>c(H+)>c(Na+)>c(OH-)
c(CH3COO-)>c(H+)= c(Na+)>c(OH-)
c(CH3COO-)>c(Na+)>c(H+)>c(OH-)
c(CH3COO-)= c(Na+)>c(H+)= c(OH-)
c(Na+)>c(CH3COO-)>c(OH-)>c(H+)
c(Na+)>c(CH3COO-)=c(OH-)>c(H+)
c(Na+)>c(OH-)>c(CH3COO-)>c(H+)
c(Na+)=c(OH-)>c(CH3COO-)=c(H+)
c(OH-)>c(Na+)>c(H+)>c(CH3COO-)
2、此题也可以采用NaOH溶液中滴加CH3COOH溶液的方式来考查,还可以用NH3·H2O与盐酸的组合来考查。
3、建议在草纸上将完整的图像和五个点画出来,边思考,边琢磨,边理解。
四、水溶液平衡中重要的计算技巧-两步计算法
1、两步计算法
a、先反应计算:只进行反应计算或溶解计算,不考虑形成平衡的影响。
b、再平衡计算:再考虑平衡体系的形成造成的影响,进行新的浓度计算。
计算过程为:先写出反应方程式。进行反应计算。再写出平衡方程式,写出平衡常数表达式,将已知数据代入,进行平衡计算。
在此计算过程中需要近似计算,反应计算已经计算出来的不为0的数据是一般是不会再修改的,反应计算中认为是0的有些数据,在平衡计算时,才会利用平衡常数解出不为0的数据。
2、示例
(1)常温下Ag2SO4的Ksp为2.6×10-12,在0.002mol/L 的AgNO3溶液中,加入一些Ag2SO4固体求溶液中SO42-浓度为。
A:在考虑溶解平衡之前:AgNO3与Ag2SO4固体的混合溶液中
c(Ag+)=0.002mol/L,c(NO3-)=0.002mol/L,C(SO42-)=0mol/L。
B:在考虑溶解平衡之后:c(Ag+)=0.002mol/L(不为0的数据保持不变)。
Ag2SO4(s)⇌2Ag+(aq)+SO42-(aq)
根据Ksp= c2(Ag+)×c(SO42-),
c(SO42-)=Ksp/c2(Ag+)=2.6×10-12/(0.002)2mol/L =6.5×10-7mol/L。
(2)常温下H2CO3的Ka1=4×10-7,Ka2=5×10-11,0.1mol/L 的NaHCO3溶液的pH=8,则溶液中的CO32-的浓度为,H2CO3的浓度为。
a:在考虑电离平衡和水解平衡之前:0.1mol/L 的NaHCO3溶液中,c(Na+)=0.1mol/L,c(HCO3-)=0.1mol/L,c(H+)=1×10-8mol/L,c(OH-)=1×10-6mol/L,c(CO32-)=0mol/L,c(H2CO3)= 0mol/L
b:在考虑电离和水解平衡之后:c(HCO3-)=0.1mol/L,c(H+)=1×10-8mol/L,c(OH-)=1×10-6mol/L
HCO3-⇌CO32-+H+
根据Ka2= c(CO32-)×c(H+)/c(HCO3-),
c(CO32-)=Ka2×c(HCO3-)/c(H+)=5×10-11×0.1/1×10-8mol/L=5×10-4mol/L
HCO3-+H2O⇌H2CO3+OH-
根据Kh=Kw/Ka1= c(H2CO3)×c(OH-)/c(HCO3-)
c(H2CO3)=(Kw/Ka1)×c(HCO3-)/c(OH-)=(1×10-14/4×10-7)×0.1/1×10-6mol/L =2.5×10-3mol/L
(3)常温下AgCl的Ksp为1.6×10-10,在2L 0.01mol/L 的NaCl溶液中,加入一些0.03mol AgNO3固体,充分反应后溶液中Cl-浓度为。
a:先进行反应计算:AgNO3+NaCl=NaNO3+AgCl↓
n(AgCl)=0.02mol,c(Ag+)=0.005mol/L,c(NO3-)=0.015mol/L,c(Na+)=0.01mol/L,c(Cl-)=0mol/L。
b:在考虑溶解平衡之后:c(Ag+)=0.005mol/L
AgCl(s)⇌Ag+(aq)+Cl-(aq)
根据Ksp= c(Ag+)×c(Cl-),
c(Cl-)=Ksp/ c(Ag+)=1.6×10-10/0.005 mol/L =3.2×10-8mol/L。
【练习】
1、写出写出下列溶液的三大守恒关系式和粒子排列顺序
(1)CaCl2溶液。(2)H2SO4溶液。(3)CuCl2溶液。(4)Na2S溶液。(5)NaHS溶液(碱性)。(6)NaClO与HClO等量的混合溶液(显碱性)
(7)挑战:CH3COONH4溶液(醋酸与氨水的电离能力相同) (8)挑战:NH4Fe(SO4)2溶液(氨水的电离能力大于氢氧化铁的)
2、常温下,用0.1000 mol/L NaOH溶液滴定20.00mL0·1000mol/L CH3COOH溶液所得滴定曲线如下图。下列说法正确的是:滴定过程中可能出现:
A.c(CH3COOH)>c(CH3COO-)>c(H+)>c(Na+)>c(OH-)
B.点①所示溶液中:c(CH3COO-)+c(OH-)=c(CH3COOH)+c(H+)
C.点②所示溶液中:c(Na+)=c(CH3COOH)+ c(CH3COO-)
D.点③所示溶液中:c(Na+)>c(OH-)>c(CH3COO-)>c(H+)
3、计算:
(1)常温下CH3COOH的电离常数为2×10-5,求0.2mol/L 的CH3COOH溶液中c(H+)浓度为 。
(2)常温下CH3COONa的Kh=6×10-10,含CH3COONa0·02mol/L、NaOH0·01mol/L 的混合溶液中,CH3COOH的浓度为 。
(3)常温下CH3COOH的电离常数为2×10-5,求0.003mol/L 的CH3COOH溶液与0.002mol/L 的NaOH溶液等体积混合后,溶液中的c(H+)浓度为 。(注意体积的变化及对浓度的影响)
(4)Ag2S的溶度积为3.2×10-50,只有Ag2S的悬浊液中Ag+浓度为 。
【练习答案】
1、(1)电荷守恒:2c(Ca2+)+c(H+)=c(Cl-)+c(OH-)
物料守恒:2c(Ca2+)= c(Cl-)
质子守恒:c(OH-)= c(H+)
粒子的浓度大小排列顺序:2c(Ca2+)= c(Cl-)>c(OH-)=c(H+)
或c(Cl-) >c(Ca2+)>c(OH-)=c(H+)
(2)电荷守恒或质子守恒:c(H+)=2c(SO42-)+ c(OH-)
粒子的浓度大小排列顺序:c(H+) > c(SO42-) >c(OH-)
粒子的浓度大小排列顺序:c(OH-)>c(Na+)> c(H+)
(3)电荷守恒:2c(Cu2+)+c(H+)=c(Cl-) + c(OH-)
物料守恒:2c(Cu2+)+ 2c[Cu(OH)2]= c(Cl-)
质子守恒:c(H+) = c(OH-)+ 2c[Cu(OH)2]
粒子的浓度大小排列顺序:c(Cl-) > c(Cu2+)> c(H+)> c[Cu(OH)2] > c(OH-)。
(4)电荷守恒:c(Na+)+c(H+)=2c(S2-)+c(HS-)+c(OH-)
物料守恒:c(Na+)=2[c(S2-) +c(HS-)+c(H2S)]
质子守恒:c(OH-)= c(H+)+ c(HS-)+2c(H2S)
粒子的浓度大小排列顺序:c(Na+)> c(S2-)> c(OH-)>c(HS-)>c(H2S) >c(H+)。
(5)电荷守恒:c(Na+)+c(H+)=2c(S2-)+c(HS-)+c(OH-)
物料守恒:c(Na+)=c(S2-) +c(HS-)+c(H2S)
质子守恒:c(H+)+c(H2S) = c(OH-) +c(S2-)
粒子的浓度大小排列顺序:c(Na+) > c(HS-)> c(OH-)>c(H2S) >c(H+)> c(S2-)。
(6)NaClO与HClO等量的混合溶液(显碱性)
电荷守恒:c(Na+)+c(H+)=c(ClO-) + c(OH-)
物料守恒:2c(Na+)=c(ClO-)+ c(HClO)
质子守恒:c(OH-)-c(H+)= c(HClO)-c(Na+)=c(Na+)- c(ClO-)= [c(HClO)- c(ClO-)]/2
粒子的浓度大小排列顺序:c(HClO)>c(Na+)>c(ClO-)>c(H+)>c(OH-)
(7)电荷守恒:c(NH4+)+c(H+)=c(CH3COO-)+c(OH-)
物料守恒:c(NH4+) +c(NH3·H2O)=c(CH3COO-)+c(CH3COOH)
质子守恒:c(H+)+c(CH3COOH) = c(OH-)+c(NH3·H2O)
粒子的浓度大小排列顺序:c(NH4+)= c(CH3COO-)>c(CH3COOH) = c(NH3·H2O)> c(OH-)=c(H+)。
本题默认了NH3·H2O在水中不再分解为NH3。
(8)电荷守恒:c(NH4+)+3c(Fe3+)+c(H+)=2c(SO42-)+c(OH-)
物料守恒:2[c(NH4+) +c(NH3·H2O)]= 2{c(Fe3+)+c[Fe(OH)3]}= c(SO42-)
质子守恒:c(H+) = c(OH-) +c(NH3·H2O) +3c[Fe(OH)3]
粒子的浓度大小排列顺序:c(SO42-)> c(NH4+)>c(Fe3+)>c(H+) > c[Fe(OH)3]>c(NH3·H2O)> c(OH-)。
2、A
3、(1)0·01mol/L。
(2)1·2×10-9mol/L。
(3)1×10-5mol/L。
(4)4×10-17mol/L。

- 全部评论(0)
