难点六、解决速率变化与平衡移动的图像问题
时间:2021-04-15 14:18 来源:高中化学教学研究 作者:张德金 点击: 次 所属专题: 化学平衡图像
版权申明:凡是署名为“化学自习室”,意味着未能联系到原作者,请原作者看到后与我联系(邮箱:79248376@qq.com)!
一、学完了反应速率的计算和影响因素之后,对于可逆反应而言,有几件事还是没有弄明白,或者容易混淆。
对于A(g)+2B(g)⇌C(g)来说,
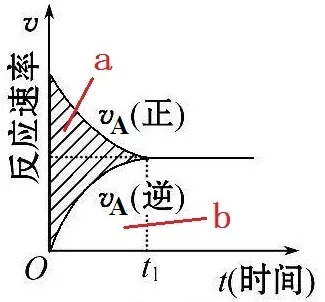
1、我们平时计算的反应速率是平均反应速率。而速率图像上的点是即时反应速率。
若计算0-t1时间内A的反应速率,我们平时一般计算的是A的总的消耗速率,而且是平均消耗速率。
2、对于正在正向进行的可逆反应来说,v(总)=v(正)-v(逆)。
当v(总)为0,即v(正)=v(逆)时,体系达到平衡状态。
对于上面的可逆反应来说,A的正反应速率是指A的消耗速率,A的逆反应速率是指A的生成速率。
上图中的面积b是逆反应造成的A的浓度增加量。面积a+b表示的是正反应造成的A的浓度减少量,面积a表示总反应速率造成的A在体系中的真实的浓度减少量。
3、A的正反应速率由A与B的浓度决定。A的逆反应速率由C的浓度决定。
4、用B计算出来的各项数据与A计算出来的数据不同,但含义相同。
5、图像的变化含义:
对于正反应来说,随着反应的进行,反应物被消耗,浓度在降低,正反应速率变慢。
对于逆反应来说,随着反应的进行,生成物在增加,浓度在提高,逆反应速率变快。
当v(正)=v(逆)时,反应物不再被消耗,生成物不再增加,反应速率也不再变化,体系达到平衡状态。
二、条件变化时,速率的变化及平衡的移动。
以A(g)+2B(g)⇌C(g) △H<0为例
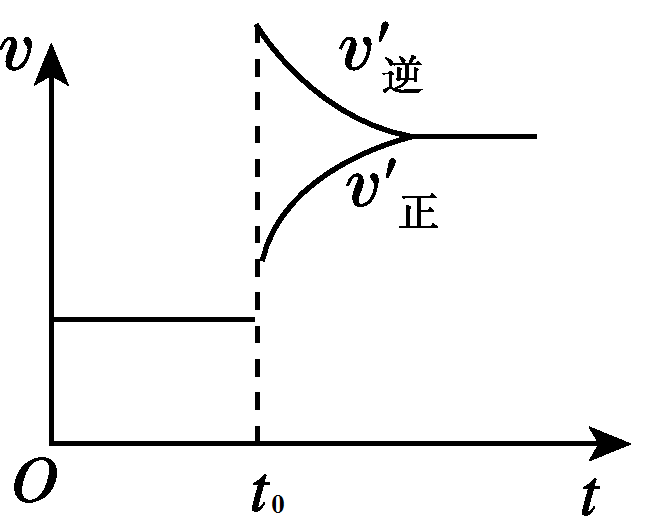
1、达到平衡后,在t0时刻时,当体系的温度升高时,正、逆反应的温度都升高,v(正)和v(逆)都加快。又根据勒夏特列原理,平衡逆向移动,说明v(逆)> v(正)。图像如下图所示:
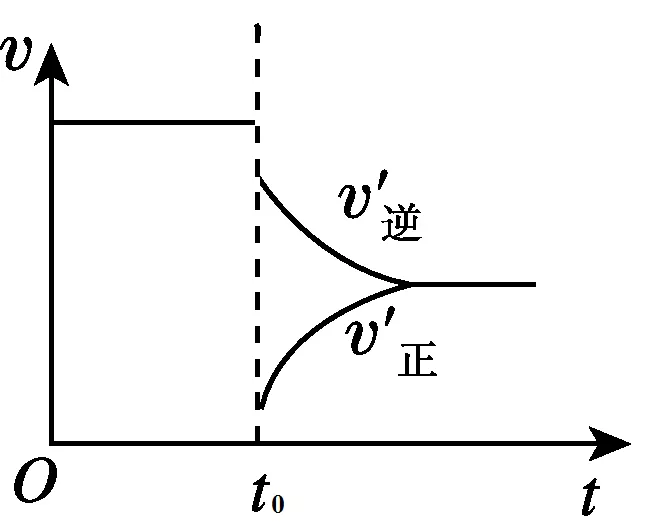
2、达到平衡后,在t0时刻时,当体系的压强减小,体积增大时,A、B、C的浓度都降低,v(正)和v(逆)都减小。又根据勒夏特列原理,平衡逆向移动,说明v(逆)> v(正)。图像如下图所示:
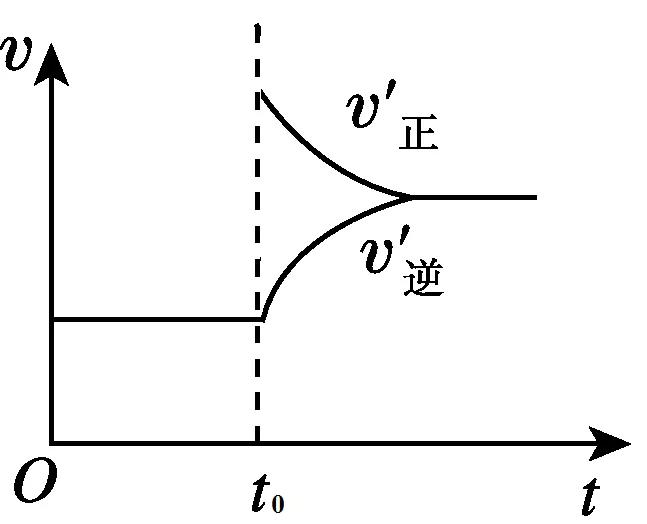
3、达到平衡后,在t0时刻时,当增加A的浓度时, v(正)增大,v(逆)在t0时不变。图像如下图所示:
4、达到平衡后,在t0时刻时,当加入催化剂时, v(正)、v(逆)都增大,且增加幅度相同。图像如下图所示:
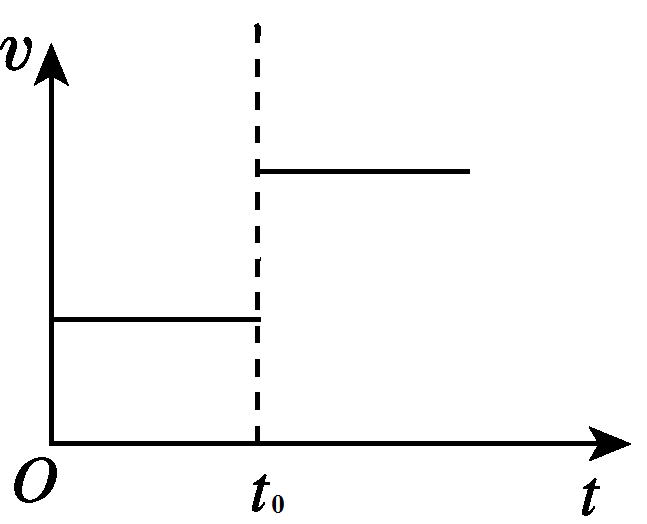
三、两个特殊例子
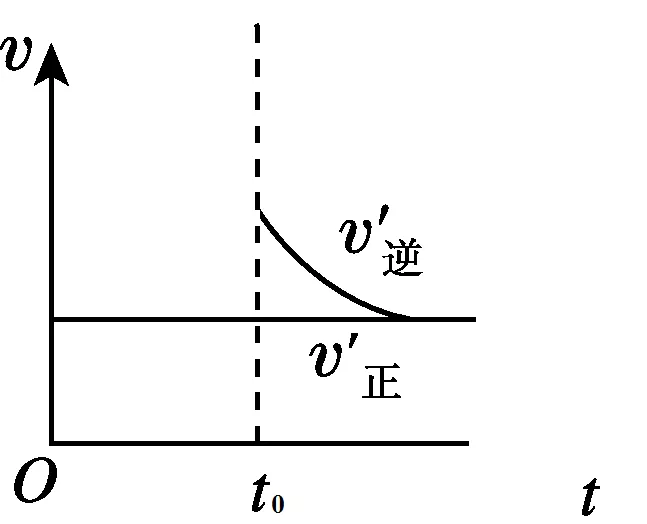
1、CaCO3⇌CaO+CO2(g)
当增加压强,缩小体积时,CO2的浓度提高,逆反应速率增加。图像如下图所示:
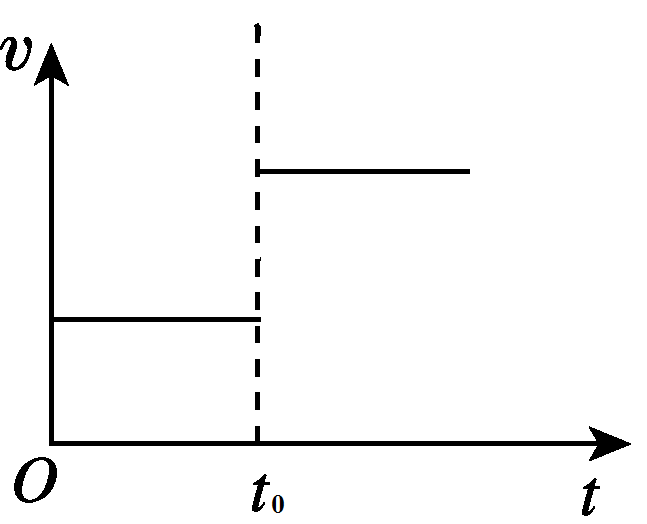
2、CO+H2O(g)⇌CO2+H2
当增加压强,缩小体积时,反应物生成物的浓度提高,正、逆反应速率都增加。根据勒夏特列原理,平衡不移动,说明v(正)=v(逆)。图像如下图所示:
【练习】
1、对于可逆反应N2+3H2⇌2NH3 ΔH<0。
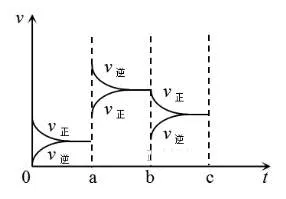
问a和b 分别改变的是什么条件? a: 。b: 。
2、下图为N2+3H2⇌2NH3 △H<0的逆反应速率图像。问t2、t6、t8分别改变的是什么条件?
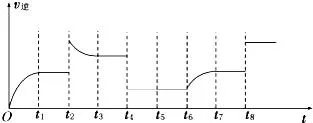
t2: 。t6: 。t8: 。
【练习答案】
1、升温。减少NH3浓度。
2、加NH3或升温。加N2或H2。加催化剂。

- 全部评论(0)
