化学反应速率与平衡陌生图像的解读
时间:2020-03-31 11:37 来源:未知 作者:化学自习室 点击: 次 所属专题: 化学平衡图像
版权申明:凡是署名为“化学自习室”,意味着未能联系到原作者,请原作者看到后与我联系(邮箱:79248376@qq.com)!
陌生图像在化学反应速率和化学平衡试题中的呈现已成为近年全国卷试题的一种趋势,但由于图 像的陌生,很多学生不能迅速地将图像转化,或胡乱解读、或放弃解答,导致此类试题失分严重。其实结合图像理清思路,运用所学原理是可以快速解答的, 文章通过几例加以说明。
一、化学反应速率-质量百分含量图像
通常化学平衡的移动是通过正、逆反应速率的变化和相对大小的辨别进行图像的设置与分析,建立化学平衡后改变外界条件使得正、逆化学反应速 率不再相等,平衡正(或逆)向移动建立新平衡,结合平衡的移动方向确定体系中各量分数的变化。
例1 (2015年高考•课标全国卷题28节选) BodensTeins研究了下列反应:2HI( g) H2(g) +I2(g) ΔH= +11 kJ • mol-1
H2(g) +I2(g) ΔH= +11 kJ • mol-1
在716 K时,气体混合物中碘化氢的物质的量 分数x(HI)与反应时间t的关系如表1所示.
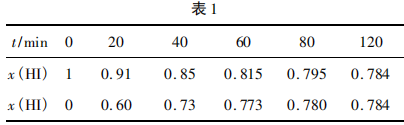
由上述实验数据计算得到v(正)〜x (HI)和v(逆)〜 x(H2)的关系可用图1表示,当升高到某一温度时,反应重新达到平衡,相应的点分别为( )(填字母).
答案:A点、E点
解析:原平衡时,x(HI)为0.784, x (H2)为 0. 108, 二者图中纵坐标均约为1.6(即v(正)=v(逆)),恰好处在平衡点。升高温度,正、逆反应速率均加快,对应两点在1.6上面,即可排除C、F两点;升高温度, 平衡向削弱温度升高的正反应方向移动,x(HI)减小(A点符合),x(H2)增大(E点符合)。
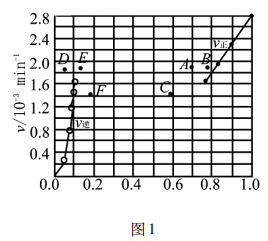
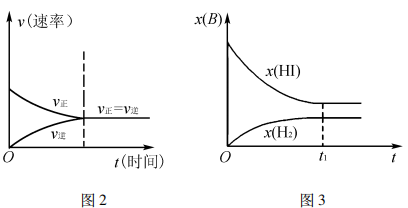
提升本题:本题的图像识别是一大难点,本图描述了化学反应速率v与碘化氢的物质的量分数x( HI),通常情况下表述的图像有:v - t图(图2)、 x(B) -t图(图3),不难发现,反应从正向建立,随着反应的推进,v(正)减小的同时v(逆)增大,建立平衡时, v(正)=v(逆)≠0,反应在题图中,两反应速率v线端点均为1.6 (即表达相等,处于平衡);x (HI)最大、x(H2) =0,随着反应的推进,x(HI)逐渐减小、x(H2)逐渐增大,两相结合即可分析出该题图表达的内涵。
二、单向化学反应速率的陌生图像
如上述分析,化学反应建立或者平衡移动过程 中,均涉及正、逆在发生变化,微观化学反应速率较大的方向即是宏观化学反应进行的方向。改变外界条件时,外界因素变化的一方化学反应速率变化:如 改变正、逆同方向变化(即同时增大或同时减小),吸热方向受到的影响程度较大;改变压强,v(正)、 v(逆)同方向变化(即同时增大或同时减小),体积减小 方向受到的影响程度较大,等体积反应同等程度变化;使用催化剂,v(正)、v(逆)同程度变化;改变反应物 (生成物)浓度的瞬间,v(正)(或v(逆))改变,v逆(或v(正))不变。
例2将N2、H2按物质的量比为1:3的比例混合于5L 的恒容密闭容器中进行反应:N2+3H2 2NH3 ΔH <0,若该反应的逆反应速率随时间变化的关系如图4所示.则t1时改变的条件不可能是( )
2NH3 ΔH <0,若该反应的逆反应速率随时间变化的关系如图4所示.则t1时改变的条件不可能是( )
A.升温
B.使用催化剂
A.加入一定量NHg
D.加入一定量N2
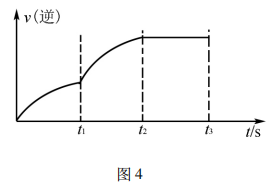
答案:D
解析:升高温度,v(正)、 v(逆)均增大,v(逆)增加的多,若t1未建立平衡,仍有可能 v(正)> v(逆),反应正向进行建 立平衡(如图5甲),A项 合理;加入催化剂,v(正)、v(逆)同等程度增大,若t1未建立平衡,仍有v(正)> v(逆),反应正向进行建立平衡(如图5 乙),B项合理;加入一定量 NH3,v(逆)增大、v(正)不变,若t1未建立平衡,仍有v(正)> v(逆),反应正向进行建立平衡 (如图5丙),C项合理;加入一定量N2,v(正)增大、v(逆)不 变,D项不合理。
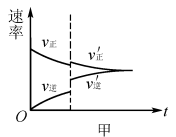
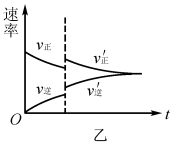
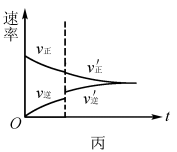
易错点拨:很多学生 解答该题时,直接将t1时刻认定为怡好建立平衡的时刻点,改变外界条件使用平衡移动原理解答问题,即有升温平衡逆向移动(v(逆)增加的多,增加后减小),A项错 误;使用催化剂,v(正)、v(逆)同等程度增大,平衡不移动,B 项错误;加入一定量N2平衡逆向移动(v(逆)先增加后减小),D项错误。解答这样的试题时关键不要形成定势思维,改变外界条件时不一定已经建立平衡。
3.多因素影响化学反应速率的陌生图像
在化学平衡移动时,理论分析一般定一议二,即仅仅是改变某一因素导致化学反应速率,从而导致 v(正)≠v(逆),平衡发生移动。但实际平衡建立或者平衡移动的过程中,都不只是一种外界条件在变化,因此变化的方向将由主要因素来决定。
例3向绝热恒容密闭容器中通入SO2和NO2, 一定条件下使反应:SO2(g) +NO2(g) SO3(g) +NO( g)达到平衡,正反应速率随时间变化的示意图如图6所示,由图可得出的正确结论是( ).
SO3(g) +NO( g)达到平衡,正反应速率随时间变化的示意图如图6所示,由图可得出的正确结论是( ).
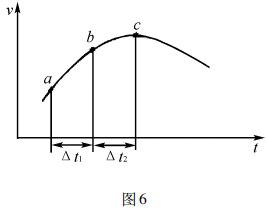
A.反应在c点达到平衡状态
B.反应物浓度:a点小于b点
C.反应物的总能量低于生成物的总能量
D.Δt1= Δt2时,SO2的转化率:A〜B段小于B〜C段
答案:D
解析:建立平衡后v(正)=v(逆),不改变条件v(正)数值恒定,图像中v(正)持续变化,即尚未建立平衡,A项 错误;反应正向建立平衡,反应物浓度逐渐减小,B 项错误;反应从正向建立,正因反应物浓度下降而 减小,但v(正)在开始一段时间增加,只能是体系温度升高使化学反应速率增大,且在开始一段时间主导, 即反应放热,反应物的总能量高于生成物的总能量, C项错误;结合图像,A〜B段的速率低于B〜C段,即 相同时间内A〜B段的转化量少于B〜C段,SO2的转化率:A〜B段小于B〜C段,D项正确。
理论分析:该反应是向密闭容器中通入反应物,即反应从正向建立化学平衡。随着反应的进行 c反减小,v(正)应逐渐减小,但结合图像,v(正)开始一段时间在增大,说明反应放热使体系温度升高,v(正)增大, 且温度是前一段速率变化的主导因素,点之后v(正)开始减小,是由于c反下降严重,同时随着反应进行放出的热量减少,c反下降成为导致速率变化的主导因素。
试题的解答中,内容的呈现陌生度也会影响学 生的解答,学会将陌生的信息转化成熟悉的信息,并 将这些陌生的信息积累、总结、归纳,在试题中再次遇到时便不再陌生,即便陌生,有将陌生信息转化成 熟悉信息的思路也会快速完成解答。

- 全部评论(0)
