难点四:突破电子式书写的困惑
时间:2021-04-15 14:45 来源:高中化学教学研究 作者:张德金 点击: 次 所属专题: 电子式
版权申明:凡是署名为“化学自习室”,意味着未能联系到原作者,请原作者看到后与我联系(邮箱:79248376@qq.com)!
要求掌握的或能推理书写的电子式,都是利用了建立在“路易斯理论”上的书写规则。
这个规则是:每个原子的周围形成离子键或共价键后,有且只有8个电子,这样原子或离子才会处于稳定状态,又叫8电子的稳定结构。(H、Li、Be为2个)
1、简单的离子化合物的书写方法
(1)理解离子的形成过程。
金属原子与非金属原子,通过失去或得到电子,使最外层变为8电子的稳定结构。
Na-e-=Na+,Mg-2e-=Mg2+,Al-3e-=Al3+。
Cl+e-=Cl-,O+2e-=O2-,N+3e-=N3-。
(2)把握离子化合物的电子式的书写格式。
如NaCl的电子式为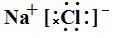 或
或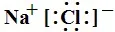 。
。
单原子的阳离子没有中括号,没有电子,只有正电荷。单原子的阴离子有中括号,有4对电子,有电荷。
多原子的阳离子和阴离子都有中括号,有电子,有电荷。
(3)书写方法:先推理出原子最外层变为8个电子失去或得到的电子数,阳离子写出对应的离子,阴离子周围点上8个电子,加上中括号,再写上电荷数。
如MgO:Mg最外层有2个电子,要失去2个电子,写Mg2+,O最外层有6个电子,要得到2个电子,写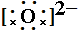 ,合起来写为
,合起来写为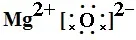 。
。
又如MgCl2的电子式: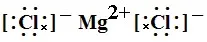 。
。
2、简单的共价化合物的书写方法
(1)理解共价键的形成过程。
非金属原子与非金属原子,通过形成共用电子对,使最外层变为8电子的稳定结构。要计算三个数据:
①根据非金属原子的最外层电子数,计算达到8个电子时,缺几个电子。缺几个,就会形成几对共用电子对。
②非金属原子在形成几对共用电子对时,一般要拿出几个电子。
③还要计算非金属原子自己剩下几对电子。
如O,最外层有6个电子,缺2个电子,需要形成2对共用电子对。O在形成2对共用电子对时,拿出2个电子。自己还剩下4个电子,也就是2对。
(2)把握共价化合物的书写格式。
如HCl的电子式为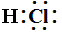 或
或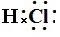 ,没有电荷,没有中括号,只有电子。
,没有电荷,没有中括号,只有电子。
(3)书写方法:
①先把每个原子需要形成的共用电子对数和自己剩余的电子对数计算出来。
②将需要形成共用电子对数最多的原子放在中心位置,其它原子放在周围位置。
③把原子之间的共用电子对点好。保证满足每个原子所需要的共用电子对数。
④把每个原子自己的电子对点好,不要点在两个原子之间。
如N2的电子式书写过程:
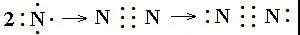
先根据N的最外层有5个电子,计算出需要形成3对共用电子对,N需要拿出3个电子,剩余1对电子。先在两个N之间点上3对共用电子对,再在每个N上点上1对电子。
如NH3的电子式书写过程:

先根据N和H计算出,N需要形成3对共用电子对,剩余1对电子。H需要形成1对共用电子对,没有剩余电子。将N放在中心,H放在N周围,先将3对共用电子对点好,再将N上的1对电子点好。
如CO2电子式书写过程:
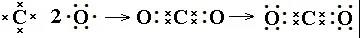
先根据C和O计算出,C需要形成4对共用电子对,没有剩余电子。O需要形成2对共用电子对,剩余2对电子。将C放在中心,O放在C周围,先将4对共用电子对点好,再将每个O上的2对电子点好。
3、带有共价键的离子化合物的书写方法
(1)理解带有共价键的离子化合物的形成过程。
离子之间有得失电子,离子内部有共用电子对的形成。阳离子对应的原子或原子团失去电子给阴离子对应的原子或原子团之后,阳离子或阴离子还不满足8个电子的稳定结构,还需要形成一些共用电子对。
(2)把握带共价键的离子化合物的书写格式。
离子之间用离子化合物的电子式的书写格式,离子内部用共价化合物的电子式的书写格式。
(3)书写方法:
先推理形成离子失去或得到的电子数,再计算阳离子或阴离子的原子团中原子失去或得到电子后,还需要形成的共用电子对数和剩余的电子对数,再根据共价化合物的书写方法,写出阳离子或阴离子的电子式,最后写出化合物的电子式。
如Na2O2电子式的书写过程:
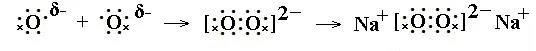
2个Na各失去1个电子后,变为2个Na+。2个O共得到2个电子后,每个O最外层为7个电子,需要形成一对共用电子。
【练习】
写出CS2、HCN、NH4Cl、CaC2、NaOH的电子式。
【练习答案】
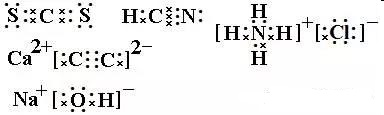

- 全部评论(0)
