氧分子的电子式怎样写?
时间:2021-11-09 16:05 来源:未知 作者:王笃年 点击:次 所属专题: 电子式
版权申明:凡是署名为“化学自习室”,意味着未能联系到原作者,请原作者看到后与我联系(邮箱:79248376@qq.com)!
在探寻物质微观结构的过程中,人们首先发现了原子的“最外层8 电子稳定结构学说”,此学说可以很好地解释稀有气体原子、NaCl等离子化合物、HCl、H2O等小分子化合物以及卤素单质X2、N2等常见气体单质具有稳定结构。那时,人们以为O2分子中2个 原子间通过2个共用电子对结合,以满足彼此的最外层8电子结构,用电子式![]() 表示。
表示。
科学总是在不断发展的,后续的深入研究中,人们发现,O2分子内存在成单电子———因为O2具有磁性(也叫“顺磁性”,具有顺磁性的物质在磁场内会受到磁场作用而产生磁极),如图1所示:
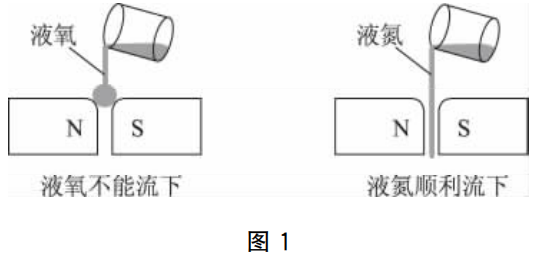
现代物质结构理论指出,物质的磁性与其内部含有的成单电子数有关,如果一种物质内部的所有电子都是以电子对的形式存在,该物质就不可能具有磁性,在磁场中不会受到任何影响。如图1所示的液氮可以依靠自身重力顺利穿过强磁场而流下,而液氧则不然,它会囤积在N、S两磁极间的缝隙上方。
对此,“8电子学说”关于O2的分子结构的结论,显然不能给出合理解释,因为电子式![]() 表达的意思是O2分子内所有原子均已成对,为解释O2含有单电子的结构问题,科学家提出了分子轨道理论—在分子内,原子轨道相互作用形成不同能量的分子轨道,分子中的所有电子在所有分子轨道内依据泡利原理、能量最低原理、洪特规则进行填充。氧原子价层的3个p轨道相互作用组合成的新轨道为4组— 按照能量由低到高依次为
表达的意思是O2分子内所有原子均已成对,为解释O2含有单电子的结构问题,科学家提出了分子轨道理论—在分子内,原子轨道相互作用形成不同能量的分子轨道,分子中的所有电子在所有分子轨道内依据泡利原理、能量最低原理、洪特规则进行填充。氧原子价层的3个p轨道相互作用组合成的新轨道为4组— 按照能量由低到高依次为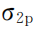 (1个轨道,能量低,称为“成键轨道”)、
(1个轨道,能量低,称为“成键轨道”)、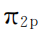 (2个等价的成键轨道)、
(2个等价的成键轨道)、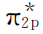 (2个等价轨道,能量高,称为反键轨道)、
(2个等价轨道,能量高,称为反键轨道)、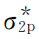 (1个反键轨道),2个氧原子共8个2p电子在分子轨道内填充的结果是:(
(1个反键轨道),2个氧原子共8个2p电子在分子轨道内填充的结果是:(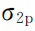 )2(满)、(
)2(满)、(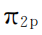 )4(2个等价轨道全满)、(
)4(2个等价轨道全满)、(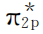 )2(2个等价轨道均半满)、(
)2(2个等价轨道均半满)、(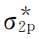 )0(1个轨道未填充电子),O2分子中的单电子正是处于
)0(1个轨道未填充电子),O2分子中的单电子正是处于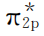 反键轨道上的2个单电子(依据洪特规则,它们应该分占不同轨道且自旋相同)。
反键轨道上的2个单电子(依据洪特规则,它们应该分占不同轨道且自旋相同)。
那么,O2的电子式到底应该如何写呢?有的教科书根据原子轨道最大重叠原理,结合分子轨道理论研究的结果,给出了如下结构示意图:
 ,
,
2个氧原子之间的 1个电子对是通过p轨道“头碰头”重叠形成的σ键,虚线框内的 3个电子通过相互平行的p轨道“肩并肩”重叠形成π键,同样的π键有2个,这个结构不是基于传统价键理论写出的,当然也就不能满足每个氧原子最外层的8电子结构。

- 全部评论(0)
