第二十讲:分子结构与性质(二)范德华力分子结构与性质的关系
时间:2022-08-06 10:24 来源:高中化学教学研究 作者:张德金 点击: 次 所属专题: 分子间作用力 分子极性 键的极性 氢键02
版权申明:凡是署名为“化学自习室”,意味着未能联系到原作者,请原作者看到后与我联系(邮箱:79248376@qq.com)!
三、键的极性、分子的极性、范德华力、氢键
1、键的极性
共价键分为极性键和非极性键。极性是因为键的两端的原子带正负电荷,是由于共用电子对的偏移引起的。在电负性中,我们知道不同元素的原子对键合电子的吸引力不同。这会导致不同元素的原子形成的共价键的共用电子对会向一边偏移,偏向的一方显负电,偏离的一方显正电。这样的键叫极性键。
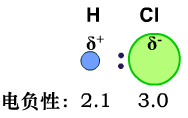
不同化学键的极性强弱也不同。
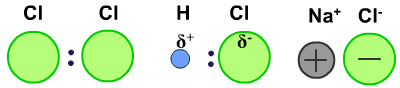
若电子对不发生偏移,则为非极性键。同种元素的原子形成的共价键是非极性键。
2、分子的极性
分子分为极性分子和非极性分子。
极性分子:正电中心和负电中心不重合的分子。
非极性分子:正电中心和负电中心重合的分子。非极性键组成的分子是非极性分子。但极性键也可能组成非极性分子。
正电中心和负电中心的空间位置,需要进行数学计算。
这儿只举一些简单的例子:
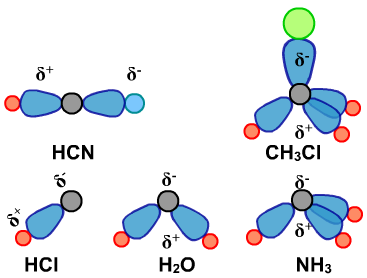
HCN、CH3Cl、HCl、H2O、NH3是极性分子。
CH4、CO2、C2H4、C2H2、BF3、PCl5、SF6是非极性分子。
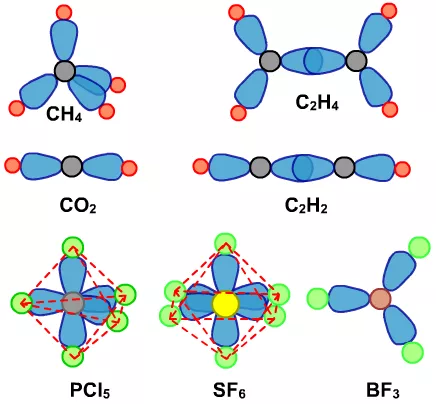
不管是轴对称、中心对称,还是旋转对称,立体对称度越高的分子,越有可能是非极性分子。
3、范德华力
范德华力,又叫分子间作用力,是分子和分子之间形成的一种比较弱的作用力,比化学键小1-2个数量级,主要在由分子组成的液态物质或固态物质中存在。
(1)范德华力的大小主要由相对分子质量的大小决定。
Cl2、Br2、I2的熔点越来越高,与相对分子质量的大小有关。
(2)范德华力的大小也和分子的间距有关,而分子的间距与分子的结构有关。范德华力与分子间距的6次方成反比。
正戊烷CH3CH2CH2CH2CH3和新戊烷C(CH3)4,分子极性都很小,沸点前者高,与分子的间距有关。
CCl2=CH2和CHCl=CHCl、邻二氯苯和对二氯苯,前者是极性分子,后者是非极性分子,都是后者的熔沸点更高。这说明分子的极性对范德华力的影响,与分子的间距比,还是分子间距是主要的。
(3)分子的极性非常大时,也会影响到分子间作用力。
CH4和H2O比,前者是非极性分子,后者是极性分子,后者的沸点高,是因为后者的极性特别特别强。
(4)范德华力无方向性和饱和性。
4、氢键及其对物质的影响
(1)氢键实际是介于范德华力和化学键之间一种分子间作用力。比化学键弱,比多数其它的范德华力强。
它是由已经与电负性很大的原子(N、O、F)形成共价键的H与另一个电负性很大的原子(N、O、F)之间的作用力。
它的描述一般用“X-H…Y”表示(X、Y都是N、O、F中的一种)。
不仅是H2O之间,NH3之间、HF之间,会形成氢键,H2O和NH3之间、H2O和HF之间、H2O和HF之间也会形成氢键。
更强的甚至形成了化学键。如NH3·H2O、NH4+、NH4F、NaHF2等。
(2)氢键不仅生成于分子之间,也生成于分子内部。
对羟基苯甲醛的氢键只能产生于分子之间,邻羟基苯甲醛的氢键可以产生在分子内部。
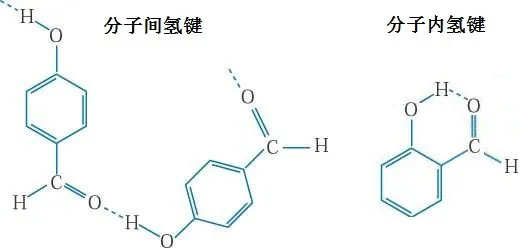
(3)氢键有一定的方向性和饱和性。
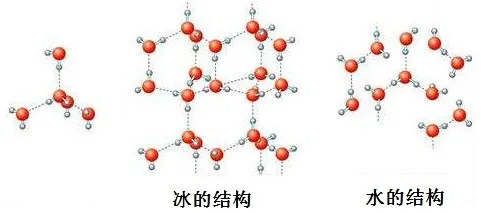
正是由于氢键有方向性和饱和性,所以冰的结构比较蓬松,密度比水的小。
(4)氢键与化学键的键长、电势差、能量的计算比较(喜欢化学计算的看)
氢键中的H…X的长度一般是H-X化学键的两倍以上,作用力与r6成反比,则为化学键作用力的1/64以下。能量与力和距离的乘积有关,所以能量应该与r5成反比。
①以N-H…N为例,N-H键长为101pm,N-H…N长为338pm,则H…N的长度为237pm,为N-H键长的2.3465倍。
若分子间距为r,r6则为167倍。所以H…N的作用力若用力来表示,则为N-H的1/167。
H…N的能量与N-H能量的r5成反比,为1/72.37。
H…N(的键能为)5.4 kJ/mol,N-H的键能为390.8kJ/mol,前者为后者的1/71.1434。
理论计算数据与实际数据基本吻合。
②以O-H…O为例,O-H键长为96pm,O-H…O长为276pm,H…O的键能为18.8 kJ/mol,O-H的键能为462.8kJ/mol。
计算得H…O的作用力为O-H的1/43.452。
计算得H…O的能量为O-H能量的1/23.174。
实际上前者的能量为后者的1/24.617。
四、分子内的键和空间构型、分子间的范德华力和氢键的关系与分子的性质的关系
1、分子的性质有哪些?
分子的性质包括物理性质和化学性质。这儿只列举一些属于分子的物质,且用键、空间构型、范德华力、氢键比较容易解释的性质。
物理性质有状态和熔沸点、溶解性和吸附性、粘性、挥发性、密度、硬度等。化学性质有还原性、不稳定性、酸性、碱性、络合性、脱水性、易加成、易取代、易消去等。
但每一个性质不一定只由一种因素决定。每一种因素也不是只影响到一种性质。
比如物理性质中的熔沸点:溴的沸点可能只决定于范德华力。水的沸点,氢键、范德华力,都起到了作用,只是氢键的作用是主要的。NaCl晶体的熔点,由晶格能决定。金刚石的熔点,由共价键决定。
又如化学性质中的还原性:单原子的还原性只与原子的失电子能力有关。HI气体的还原性,除了与I(-1)的失电子能力有关外,还与H-I的键能有关。乙烯的还原性,还与π键的不稳定有关。
2、物理性质中的状态和熔沸点、粘性、挥发性、密度、硬度等,多数都与范德华力和氢键有关。
(1)范德华力
如塑料,它是高分子化合物,每个分子的相对分子质量在几万到几百万,所以它的范德华力非常大。体现出来的物理性质是熔沸点比较高,状态自然就是固态,固态时硬度很大,处于液态时有很强的粘性,挥发性很差。
又如化学纤维,也是高分子,支链多的,分子短的,纤维分子呈团状,分子间距大,作用力小一些,这样的纤维硬度低,柔软。支链少的,分子长的,分子间距小,这样的纤维硬度大,笔挺。
(2)氢键
①熔沸点:氢键能使熔沸点升高。
H2O的熔沸点比H2S的高,HF的熔沸点比HCl的高,NH3的熔沸点比PH3的高。
②密度:液体分子间若形成氢键,有可能发生缔合现象,例如液态HF,除了HF分子外,还有通过氢键联系在一起的复杂缔合分子(HF)n。分子缔合的结果会影响液体的密度。
固态物质若形成有方向性和饱和性的氢键,会造成密度变低,如冰。
③粘度、挥发性:分子内羟基多的物质,形成的氢键也多,作用力大。所以挥发性差,密度大,粘度大。像H2SO4、H3PO4、甘油、液态糖。
羟基或氨基少的物质,氢键也少,分子间作用力也小一些,挥发性就强,密度不大,粘度小。像乙醇、H2O、氨、HNO3。
④结构:生物学中的DNA双螺旋结构正是靠氢键结合在一起的。蛋白质具有生物活性的四级结构,也是和氢键有关。
3、溶解性:分子的溶解性与分子结构和氢键都有关。
(1)极性相似的物质互相溶解:
极性分子易溶于极性分子,如HCl、HBr、HI都易溶于水。
非极性分子易溶于非极性分子,如Br2、I2易溶于苯和CCl4。
(2)结构相似的物质互相溶解。如一些烃之间相互溶解。
(3)能形成氢键的相互溶解,NH3、HF易溶于水。含N和O的很多有机物易溶于水的原因是它们与水能形成氢键。像含羟基的醇和酸,含有氨基或氮的胺,含有氧的酮、醛等,都易溶于水。不含这些原子团的有机物,则难溶于水。
(4)但对于有机物,如果一边是易溶于水的原子团,一边是易溶于非极性溶剂的原子团。当溶于水的原子团较多时,在水中溶解能力会变大。当另一边的原子团较多时,在水中溶解能力会变小,在非极性溶剂中的溶解能力会变大。
而且还能出现一边溶于水,另一边溶于非极性溶剂的情况。洗涤剂、细胞膜就都有这个特点。
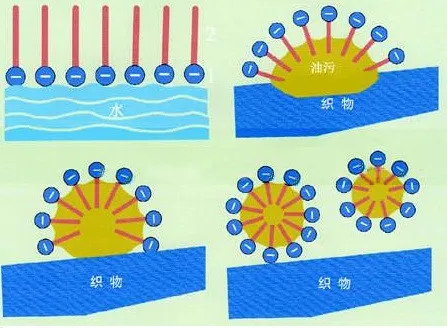
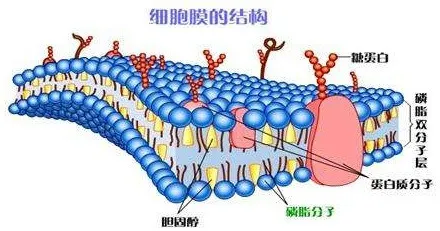
(5)高分子物质一般难溶于水。原因是高分子的相对分子质量很大,分子间作用力很强。
只有个别带很多羟基、羧基、氨基及其及盐的有机物,可能会溶于水形成胶体。
(6)在水溶性中,除了以分子形式溶于水之外,还有以离子的形式溶于水。对于离子化合物来说,离子化程度越高,一般越易溶于水。(有化学爱好的看。)
离子化程度和共用电子对的偏移程度有关。在共价键的极性原因中我们分析到,电子对越偏向于一侧,越容易形成离子化合物。所以所有的离子键,都带有一定的共价键成分。
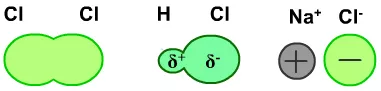
离子化程度从左到右:没有,低,高
电子对越偏向于一侧,离子化程度越高。电子对越偏向于中间,离子化程度越低。离子化程度越高的,越易溶于水。
比如,AgF、AgCl、AgBr、AgI的水溶性依次减小。原因是,F、Cl、Br、I的电负性越来越小,对电子的吸引力越来越差,原子半径又越来越大,Ag+和X-之间的电子对越来越偏向于中间,它们形成的离子键的离子化程度越来越差。所以水溶性越来越差。(极化作用造成的离子化程度降低对银盐的影响也很大)
Ag2S的水溶性比AgCl的水溶性小。原因是,S的电负性低,对中间电子对的吸引力小,S2-带两个负电荷,对中间电子对的排斥力大,电子对越来越偏向于中间,离子化程度变差,水溶性降低。
还有一种理论,是离子的极化与变形,使离子化程度降低。当离子半径很大时,离子在极化作用下容易变形,变形会导致电子云的重叠程度变高,离子化程度降低。

MgSO4、CaSO4、BaSO4的水溶性依次降低,原因就是SO42-离子半径大,带电荷数又多,自身的变形能力和对对方的极化能力都强,。随着阳离子的半径增大,阳离子被极化变形程度增大,键的离子化程度降低,水溶性降低。碳酸盐也是如此。
4、化学性质中的还原性、不稳定性、酸性、碱性、络合性、脱水性、易加成、易取代、易消去等,主要与分子中的共价键、分子立体构型有关。
(1)不稳定性
HCl、H2S、PH3、SiH4的稳定性越来越差,与原子半径变大,键长变长,键能降低,键的稳定性降低有关。
下面是关于分子自身易脱水的几种情况:
①中心原子上有多个羟基时,会脱水。
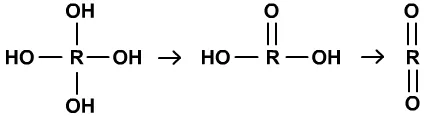
CBr4被NaOH溶液水解为Na2CO3或CH3OH被酸性KMnO4氧化为CO2都属于这种情况。SOCl2遇水水解为SO2和HCl等也属于这种情况。
这种反应很像有机物中卤代烃和醇的消去反应。只是这儿消去的是羟基和另一个O上的H,有机物的消去反应消去的羟基和另一个C上的H。
有一些金属氢氧化物的分解也和这个类似。
I、若结构相似,中心原子的原子半径越大,R对R-O键的电子云束缚能力越差,电子云越偏向于-OH,-OH的离子化程度越大,稳定性就越低。
同主族从上到下,金属氢氧化物的碱性越来越强,就是这个原因。
II、若中心原子相同,中心原子的正电性越低,R对R-O键的电子云束缚能力越差,结果也会如此。
H2SO4比H2SO3的稳定性低,与S=O的增加,导致S的正电性增加,S与-OH作用力增强,S-O键的稳定性增加有关。
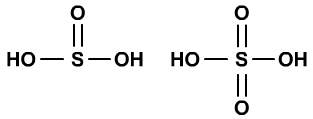
同周期金属氢氧化物的碱性从左到右越来越低与此有关。
III、中心原子上的羟基越多,羟基之间的排斥力越大,羟基也会变得不稳定,容易脱水。此时,如果中心原子的原子半径过小,也容易脱水。比如n(的含氧酸比)P的更容易脱水,它们分别以HNO3和H3PO4的形式存在。
同周期金属氢氧化物在受热的情况下稳定性从左到右越来越低与此有关。
②醇的分子内消去:原因与C-O-H中的C-O没有C-H或C-C稳定,增加一定的条件,就会发生消去反应。其它很多有机物的各种官能团的取代反应、消去反应都与这个原因有关。像卤原子的水解,酸与醇的酯化,羧基变CO2。
③结晶水的盐的脱水:原因与配位键的稳定性有关。
配位化合物的稳定性,都有其中一项原因是配位键的稳定性。配位键的稳定性,既和中心离子或原子有关,也和配体离子或分子有关。
(2)酸性
①无氧酸:
HCl、HBr、HI溶液的酸性越来越强,也与键能减小,键更易断裂,更易电离出+有关。H2S、H2Se、H2TE的酸性也是如此。
②含氧酸:
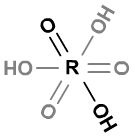
I、含氧酸的酸性与R=O数目有关,数目越多,酸性越强。原因是R=O数目越多,中心原子的正电性越大,R-O-H中间的两个键的电子云一起向左移动,导致H的极性变大,使O-H的离子键趋势增大,H更易电离。
例如,H4SiO4、H3PO4、H2SO4、HClO4的酸性越来越强。
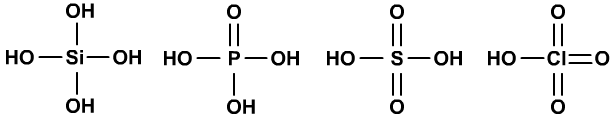
又如HNO2的酸性没有HNO3的强。
HClO、HClO2、HClO3、HClO4的酸性依次增强,也是如此。
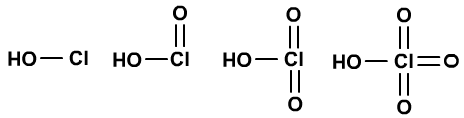
II、羟基数目对酸性的影响不大。
HNO3与H2SO4的酸性相近。
HNO2、H2SO3、H3PO4的酸性相近。
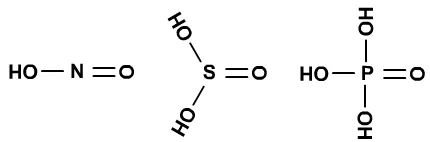
III、若结构相似,中心原子的原子半径越大,酸性越低。原因是中心原子半径越大,共用电子对离中心原子越远,中心原子对电子对的束缚能力越差,R-O-H中间的两个键的电子云一起向右移动,就导致了相反的结果。
HClO4、HBrO4、HIO4的酸性越来越低。
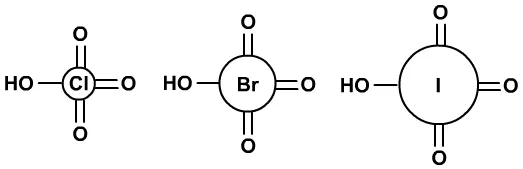
(3)易加成
这与双键或三键中的π键没有σ键稳定,易断裂,可以增加原子团有关。
不仅是烯、炔的加成,醛、酮的加成,硝基的还原,氰基的还原等,而且酸性氧化物遇水变为酸等一些无机反应,都有加成反应或最少一部分是加成反应。
有些有机物的还原反应,表面上不像加成,但实际是加成后再消去的结果。
(4)但烷与卤素单质、苯与卤素单质或含氧酸的取代、甲苯与酸性高锰酸钾的氧化不符合上面的情况。
它们的反应是有机物中比较稳定的C-H被取代为带官能团的键的反应,而我们一般认为,有机物中的C-H键比一些官能团与C之间的键稳定。所以一些反应能发生的原因还要考虑环境、催化剂、周围原子团的影响等很多因素。但既然发生,原因必定和共价键的稳定性有变化有关。
(5)分子的立体构型对化学反应的影响。
①同分异构体:
I、几元酸的辨别:分子中的H和O以羟基的形式连在中心原子上,才有可能有酸性,若分别连在中心原子上,则没有酸性。

前一个分子是二元酸,后一个分子是一元酸。这说明连中心原子的H,比连在羟基上的H在水溶液中稳定。
II、有机物同分异构体的结构不同,有些反应会不能发生,有些产物会不同。
如丙烯与HCl的加成,会出现两种产物。
如1-丁醇能氧化为丁醛或丁酸,2-醇只能被氧化为丁酮,2-甲基-2-丙醇不能被氧化。
②手性异构体的特殊反应
手性异构:如果一对分子,它们的组成和原子的排列方式完全相同,但如同左手和右手一样互为镜像,在三维空间里不能重叠,这种现象就叫手性异构。这对分子互称手性异构体。有手性异构体的分子称为手性分子。
手性异构是同分异构中的一种特殊立体异构情况。
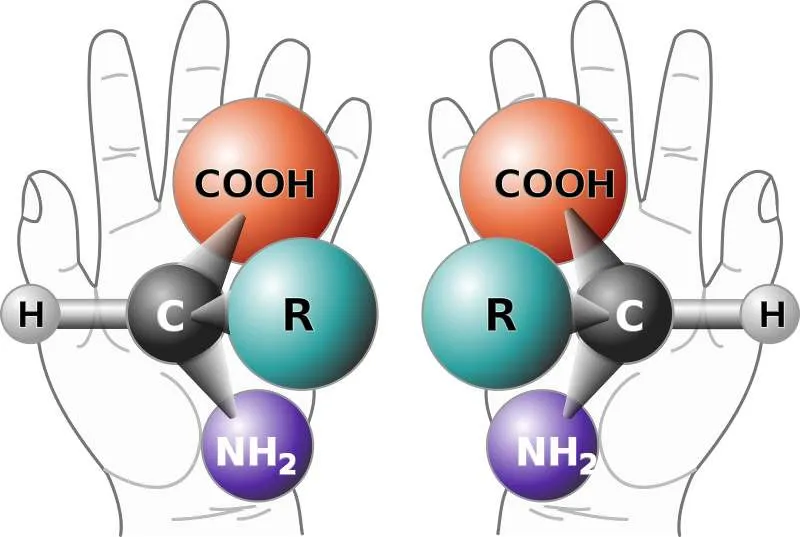
仔细辨析下面每一组上下两个物质之间的反应,左边一组能同时发生成醚反应和两个酰胺化反应。而右侧一组,不管怎么调整,都不能同时发生这三个反应。
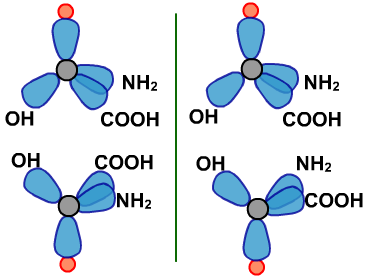
巴斯德根据酒石酸盐晶体实验,提出了分子的不对称性是生命的机理之一。生物化学中的很多高分子反应,都是手性反应。
5、对于分子呈现的颜色的分析(有化学爱好的看)
这种分析对于更复杂的化合物也同样适用。
以卤素单质为例。
氯气呈黄绿色,但HCl没有颜色,NaCl的固态和水溶液都没有颜色。说明黄绿色既不是Cl自身的颜色,也不是Cl‑或水合氯离子产生的颜色。而氯气中的氯分子之间也没有其它范德华力或晶格能等。所以黄绿色只能是Cl-Cl共价键形成的颜色。
溴蒸气是红棕色的,碘蒸气是紫色的。如果也分别是Br-Br共价键、I-I共价键引起的。那么气态分子的颜色产生,就与共价键的键能及电子的跃迁有关。
三者的颜色是由于光线照在这些分子上产生的。(在暗处,它们并没有主动发射出颜色光线)可以推理出Cl-Cl、Br-Br、I-I产生颜色的原理,应该是共价键中的共用电子向高能级跃迁时,吸收了一部分颜色光,然后让我们看到的是互补色(原子吸收光谱混合后的颜色)。
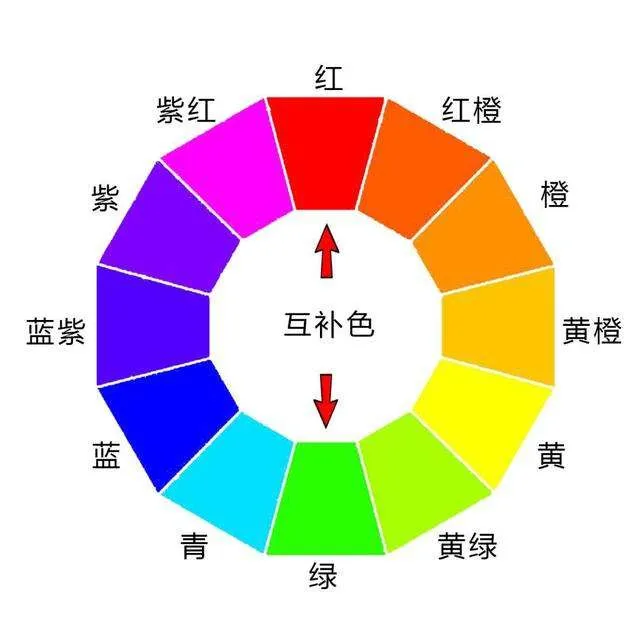
然后我们用键能做一下推理,Cl-Cl、Br-Br、I-I的键能越来越低,对共用电子的约束能力就越来越小,共价键中的电子就越来越不稳定,发生跃迁需要的能量就小,吸收的光线的能量就小。所以I-I吸收的是低能量的黄绿光,对应的互补色是紫红色。Br-Br吸收的是中能量的青蓝光,对应的互补色是红橙色。Cl-Cl吸收的是高能量的紫红光,对应的互补色是黄绿色。
由此可以推理[Cu(H2O)4]2+的蓝色与Cu2+与H2O的配位键电子跃迁有关。[Cu(NH3)4]2+的蓝色与Cu2+与NH3的配位键电子跃迁有关。
也可以推理MnO4-的紫色与Mn与O的配位键电子跃迁有关。MnO4-中Mn(+7)利用4S和4P共四个空轨道杂化为sp3后,4个8电子的O2-做为配体形成的。
当然,颜色的产生还有其它可能,如共价键的电子吸收能量后,向高能级跃迁时可能产生不了颜色,但回到某个低能量态时会产生发射光谱,如果恰好呈现颜色,就会被看到。(看到的是发射光谱混合后的颜色)
颜色的产生,也有大结构中的离域π键、晶体的特殊结构,大分子结构产生的特殊影响力等因素有关,但去除一些能判断的因素,总能找到颜色产生的关键原因。这对于主动制造出一些产生特殊颜色的物质具有重要意义。
【练习】
1、下列分子属于极性分子的是( ),属于非极性分子的是( )。
①CO2,②BF3,③CH4,④NH3,⑤H2O,⑥SO2,⑦SO3,⑧CH3Cl,⑨C2H4,⑩SF6。
2、影响范德华力的主要因素是 ,还受 和 等的影响。CO2比CS2的沸点低,是受 的影响。正戊烷比新戊烷的沸点高,是受 的影响。
3、哪些原子与H之间会产生氢键: 。
分子内氢键和分子间氢键,哪种会使沸点升高? 。冰的密度比水的密度小,是因为氢键具有 性。
4、物理性质中的状态、熔沸点、粘性、硬度等,大多和 有关。
5、HF比HCl的沸点,原因是 。CH4比CCl4的沸点,原因是 。
6、H2SO4、甘油比乙醇、水的密度、粘度大,挥发性小,是因为 。
7、一些烃之间相互溶解是因为。HCl易溶于水是因为 。
小分子的醇易溶于水不只是因为极性相似,还因为 。
一元醇的相对分子质量越大,水溶性越 。醇的羟基越多,水溶性越 。
8、分子的化学性质除了和分子内的原子有关之外,还和分子中的 和 有关。
同周期元素的最低价氢化物从左到右,稳定性越来越 ,原因是 。(从原子半径、键长、键能角度分析)
9、洗涤剂分子的结构有什么特点: 。
10、有些有机物发生取代反应,消去反应,与官能团的有关。有些有机物和无机物能发生加成反应,与 有关。
H2SO4比H2SO3的稳定性、酸性都强,原因是 。
11、带结晶水的盐易分解,与 有关。
12、什么样的醇不能发生消去反应? 。什么样的醇不能发生氧化反应? 。
【练习答案】
1、④⑤⑥⑧,①②③⑦⑨⑩。
2、相对分子质量,分子的间距,分子的极性。相对分子质量,分子的间距。
3、N、O、F,分子间氢键。方向性和饱和性。
4、范德华力和氢键。
5、高,HF能形成氢键。低,CH4的相对分子质量小。
6、H2SO4、甘油分子中含有的羟基多,形成的氢键多。
7、结构相似。结构相似(或都是极性分子)。与水能形成氢键。小,大。
8、共价键,分子立体构型。强。原子半径减小,键长变短,键能变大,键变稳定。
9、一端是易溶于水的原子团,其余为难溶于水的原子团。
10、不稳定(易断键或键能低)。π键不稳定易断。S=O多导致的S的正电性更强造成的。
11、配位键(金属离子与水的配位键)
12、羟基连的碳没有相邻碳或相邻碳上没有氢的醇。
羟基连的碳上没有氢的醇。

- 全部评论(0)
