76号之后元素及其化合物知识要点简介
时间:2024-03-21 11:30 来源:未知 作者:张德金 点击: 次 所属专题: 元素化合物简介
版权申明:凡是署名为“化学自习室”,意味着未能联系到原作者,请原作者看到后与我联系(邮箱:79248376@qq.com)!
78号铂Pt、79号金Au、80号汞Hg、82号铅Pb、92号铀U。
一、铂78Pt
银白色,俗称白金,是贵金属之一。
铂常常与金、铑、铱等元素共存于矿物中。有自然铂、钯铂矿、砷铂矿等。
铂族元素,包括钌(Ru)、铑(Rh)、钯(Pd)、锇(Os)、铱(Ir)、铂(Pt)六种金属元素,在元素周期表中属第5、6周期的VII元素。

铂具有良好的化学稳定性,易加工成形。应用于首饰、抗癌药物、催化剂、电极、耐腐蚀器皿等。
原子序数78,位于元素周期表第六周期,VII族。核外价电子排布为5d96s1。
铂的化合物都有剧毒。
1、金属铂,熔点1772℃,沸点3827℃,密度21.45g/cm3,质软,有良好的延展性、导热性和导电性。
铂的化学性质不活泼,在空气和潮湿环境中稳定,低于450℃加热时,表面形成二氧化铂薄膜,高温下能与硫、磷、卤素发生反应。
2Pt+O2=Δ=2PtO(加热温度不超过560℃)
Pt+3F2=Δ=PtF6
Pt+2Cl2=高温=PtCl4(Br2、I2也能发生类似反应)
Pt+Cl2=500℃=PtCl2
铂不溶于盐酸、硫酸、硝酸和碱溶液,可溶于王水和熔融的碱。
Pt+4HNO3+6HCl=H2[PtCl6]+4NO2↑+4H2O
铂的+2、+4比较稳定。容易形成配位化合物,如Pt(NH3)2Cl2、K[Pt(NH3)Cl5]。
海绵铂为灰色海绵状物质,有很大的比表面积,对气体(特别是氢气、氧气和一氧化碳)有较强的吸收能力。粉末状的铂黑能吸收大量氢气。
2、PtO、PtO2
(1)PtO,紫黑色粉末,550℃分解生成铂和氧。
2PtO=550℃=2Pt+O2↑
常温下被H2立即还原,生成灰色的铂海绵并放热。
PtO+H2=Pt+H2O
溶于盐酸,不溶于其他酸和王水。
PtO+4HCl=H2[PtCl4]+H2O
(2)PtO2,黑色粉末,不溶于水、浓酸和王水。空气中稳定。
优良吸氢材料,又叫亚当斯催化剂,是加氢催化剂,适用于双键、三键、芳香烃、羰基、腈、硝基还原作用。
3、卤化物
(1)PtF6,暗红色晶体,熔点为61.3℃,沸点为69.14℃。
①是强路易斯酸,溶于液态无水氟化氢,形成PtF6·XHF加合物。它们都属于超强酸,如八氟合铂酸H2PtF8。
②很不稳定。
PtF6=Δ=PtF4+F2
③强烈水解,碰到水就会迅速水解,水解产物为氟化氢,氧气和二氧化铂。
2PtF6+6H2O=12HF+O2↑+2PtO2
④具有强氧化性,氧化能力强于氟气。
六氟化铂蒸气能和稀有气体中的氙化合,生成六氟合铂酸氙(橙黄色固体)。
PtF6+Xe=XePtF6(Xe显+1价)

六氟化铂蒸气还能和氧气反应,生成六氟合铂酸二氧。
PtF6+O2=O2PtF6(O2显+1价)
(2)PtF4,橙黄色固体。
溶于水会产生二氧化铂的水合物和氢氟酸。
PtF4+(x+2)H2O=4HF+PtO2·xH2O
加强热会分解产生铂和氟气。
PtF4=高温=Pt+2F2↑
(3)(PtF5)4铂系金属的五氟化物都是四聚体。结构如下:
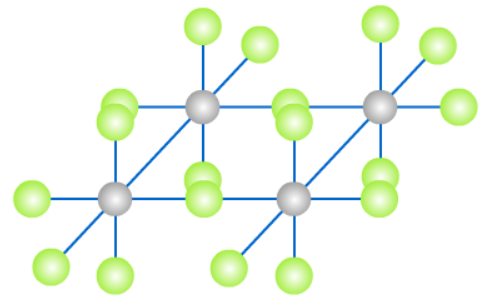
(4)PtCl4、PtCl2
PtCl4,吸湿性红褐色粉末,易溶于水,易水解。
2HCl+PtCl4=H2[PtCl6]
PtCl2,绿色晶体,微溶于水。溶于盐酸和氨水。
2HCl+PtCl2=H2[PtCl4]
PtCl2+2NH3=PtCl2(NH3)2
(5)PtBr4
分子结构为一维聚合链。
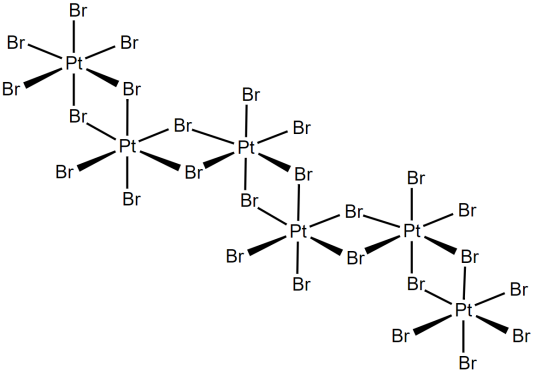
4、氢氧化铂Pt(OH)4是四价铂的氢氧化物,常温下稳定。
不溶于水的白色固体。弱碱。
它具有两性,溶于盐酸生成氯铂酸,溶于碱生成铂酸盐:
Pt(OH)4+6HCl==H2PtCl6+4H2O
Pt(OH)4+2NaOH==Na2[Pt(OH)6]
氢氧化铂热稳定性差,加热分解:
Pt(OH)4=Δ=PtO2+2H2O
制取:
PtCl4+4NaOH==Pt(OH)4↓+4NaCl
4、铂盐
(1)顺铂,顺式-二氯二氨合铂,是一种含铂的抗癌药物。临床上对卵巢癌、前列腺癌、睾丸癌、肺癌、鼻咽癌、食道癌、恶性淋巴瘤、头颈部鳞癌、甲状腺癌及成骨肉瘤等多种实体肿瘤均能显示疗效。
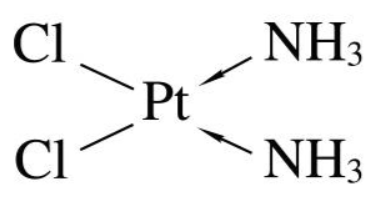
分子构形为平面形,Pt的杂化方式为Dsp2,利用DX2-Y2轨道(在Xy平面坐标系中),与Px轨道、Py轨道(也在Xy平面坐标系中),S轨道杂化时,杂化出的是平面图形。利用DX2-Y2轨道杂化的原因是,各轨道的电子云的重叠程度更高,能量降低更多,杂化出来的键更稳定。
(2)氯亚铂酸铵,(NH4)2PtCl4,用作制备二氯二氨铂的原料。
氯亚铂酸铵冷水溶液与氨水混合反应得顺式-二氯二氨铂。
(NH4)2PtCl4+2NH3=Pt(NH3)2Cl2+2NH4Cl
5、制取
(1)用王水处理矿石或生产贱金属后的副产品,得到含有H[AuCl4]、H2[PtCl4]等的溶液。
(2)向溶液中加入氯化亚铁,使金沉淀下来并从溶液中分离出去。
(3)向溶液中加入NH4Cl,使铂以氯铂酸铵(NH4)2[PtCl6]的形式沉淀下来。燃烧沉淀,可以得到海绵状的粗铂。
(4)用王水重新溶解粗铂,再向溶液中加入溴化钠溶液,以除去铑、铱的杂质。
(5)加入氨水,使铂再次以氯铂酸铵的形式沉淀下来。
(6)燃烧氯铂酸铵,得到金属铂。
二、金79Au
贵金属之一,也是货币金属之一,重要的装饰性金属。在金属市场上金与钌、铑、钯、锇、铱、铂等金属统称为贵金属。
是展性最好的金属,延性仅次于铂,是延展性最好的金属之一。
金的核外价电子排布为5d106s1,常见价态有+1和+3,主要是+3。
1、铜、银、金,位于Ib族。
铜、银、金的活泼性越来越弱,而碱金属钾、铷、铯的活泼性越来越强的原因是:
从铜到金,原子半径虽然增加但不明显,次外层D轨道电子的屏蔽能力相对较弱,使核电荷对最外层电子的吸引力增加了很多,故金属活泼性依次减弱。
如果固体参与反应,还要考虑金属的原子化热。如果在水溶液中参与反应,还要考虑金属离子的水合热。
2、金的活泼性很差,不溶于稀酸,甚至不溶于浓硝酸,只能溶于王水中:
Au+HNO3+4HCl=H[AuCl4]+NO↑+2H2O
可以在有氧气的条件下,与水溶液中的强配体发生作用。
4Au+O2+8CN-+2H2O=4[Au(CN)2]-+4OH-
3、金与氯气在200℃时反应生成AuCl3,AuCl3中存在二聚体Au2Cl6,该结构为平面结构。
2Au+3Cl2=200℃=2AuCl3
氯化金溶于盐酸。
HCl+AuCl3=H[AuCl4]
Mg(OH)2可以沉淀H[AuCl4]。
2Mg(OH)2+H[AuCl4]=Au(OH)3+2MgCl2+H2O
Au(OH)3受热会分解。
2Au(OH)3=140℃=Au2O3+3H2O
4、Au(I)化合物也存在,但不稳定,易发生歧化反应。
3Au+=Au3++2Au↓
5、金的化合物在温度较高的情况下,会分解出单质。
6、得到金的几种方法
(1)淘金,从河中淘取金砂。

狗头金
(2)汞齐法。将汞与矿粉混合,金与汞形成金汞齐,加热挥发掉汞,得到金。(此法对环境污染非常严重)
(3)氰化法。
4Au+O2+8NaCN+2H2O=4Na[Au(CN)2]+4NaOH
Zn+2[Au(CN)2]-=2Au+[Zn(CN)2]2-
三、汞80Hg:
唯一的液态金属,重金属元素之一,易造成积累中毒。
价电子的排布式为3d104s2,有+1、+2两种价态。

1、单质
(1)汞为什么呈液态?气态时以单原子形式存在金属。
IIb族的金属熔点低都较低。原因是原子半径大,次外层D轨道全充满,不参与形成金属键。最外层S轨道也全充满,金属键较弱。汞原子的6S轨道上的两个电子非常惰性,它的金属键更弱。
(2)汞可以溶解其它金属,形成汞齐。
(3)易挥发,有剧毒,处理方式是用硫黄覆盖。
Hg+S=HgS
临时贮存时,表面用10%的NaCl溶液覆盖。
(4)加热时与氧气反应。
2Hg+O2=Δ=2HgO(红色)
(5)与氯气反应时,量不同,产物不同。
2Hg(过量)+Cl2=Δ=Hg2Cl2(甘汞)
Hg+Cl2(过量)=Δ=HgCl2
(6)汞不与稀盐酸、稀硫酸反应,但与氧化性酸反应,且汞的量不同,产物的价态不同。
Hg+2H2SO4(浓)=Δ=
HgSO4+SO2↑+2H2O
6Hg(过量)+8HNO3(冷)=
3Hg2(NO3)2+2NO↑+4H2O
Hg与氢溴酸不反应,但与HI反应。
Hg+4HI=H2[HgI4]+H2↑
2、汞的+1价化合物(亚汞化合物)
在亚汞化合物中,汞总是以双聚体Hg22+的形式存在。两个汞原子之间形成了共用电子对,[Hg:Hg]2+。
(1)甘汞Hg2Cl2,白色固体,难溶于水。分子时的Hg2Cl2呈直线形。
Hg2Cl2见光分解。
Hg2Cl2=光=HgCl2+Hg
遇氨水生成白色氨基氯化汞和黑色的分散汞,产物固体呈灰色。
Hg2Cl2+2NH3(aq)=Hg(NH2)Cl+Hg+NH4Cl
(2)亚汞盐与KI溶液生成黄色沉淀。
Hg22++2I-=Hg2I2↓
当KI过量时,发生歧化反应。
Hg2I2+2KI=K2[HgI4]+Hg
3、汞的+2价化合物
(1)HgO和Hg(OH)2
Hg(OH)2在水溶液中不稳定,易分解。
汞盐与强碱溶液反应,得到黄色的HgO。
Hg2++2OH-=HgO↓+H2O
HgO受热不稳定。
2HgO=Δ=2Hg+O2↑
HgO是制备多种汞盐的原料。
HgO可做氧化剂。
HgO+SO2=Hg+SO3
(2)HgS,有红色和黑色等形态。红色的叫辰砂或朱砂。

朱砂矿
加热可得Hg。
HgS=Δ=Hg+S
除去废水中的汞离子用硫化氢或硫化物。
Hg2++H2S=HgS↓+2H+
HgS在硫化物中溶解度最小,在浓硝酸中也不溶解。但可溶于过量浓Na2S、酸性KI或王水中。
HgS+Na2S=Na2[HgS2]
HgS+4I-+2H+=[HgI4]2-+H2S↑
3HgS+8H++2NO3-+12Cl-=3[HgCl4]2-+3S+2NO↑+4H2O
(3)HgCl2
白色固体,易升华,又叫升汞。直线形共价化合物,略溶于水,有剧毒。稀溶液有杀菌作用,可用作外科手术时非金属器具的消毒剂。
在水中电离程度很小。
HgCl2遇氨水立刻产生氨基氯化汞白色沉淀。
HgCl2+2NH3(aq)=Hg(NH2)Cl↓+NH4Cl
在酸性条件下,有较强的氧化性。与盐酸酸化的SnCl2溶液反应。
2HgCl2+Sn2++4Cl-=Hg2Cl2↓+[SnCl6]2-
若SnCl2溶液过量,则继续反应,生成Hg。
Hg2Cl2↓+Sn2++4Cl-=2Hg+[SnCl6]2-
(4)奈斯勒试剂,用于检验铵根。
加KI溶液,首先得到红色沉淀。
Hg2++2I-=HgI2↓
再加KI溶液,得到无色溶液。
HgI2↓+2I-=[HgI4]2-
含[HgI4]2-的碱性溶液叫奈斯勒试剂,可用于检验铵根,有红色沉淀生成。
2[HgI4]2-+NH4++4OH-=[Hg2(NH2)O]I↓+7I-+3H2O
4、Hg的制取
常以朱砂HgS的形式存在,可用作红色颜料。
在空气中灼烧得Hg。
HgS+O2=灼烧=Hg+SO2
四、铅82Pb:
冶炼铅主要利用方铅矿PbS。元素有毒,常见重金属之一,易造成铅中毒,在人体内积累,难以排出。
核外价电子排布为5d106s26p2,第六周期的元素特点是6s2不易失去,所以铅有+2和+4价,其中+2价更稳定。
1、铅单质
公元前三千年左右人类就已经开始使用铅。
密度很大,熔点很低,质软。
(1)与氯气、氧气、硫等直接化合。
Pb+Cl2=Δ=PbCl2
2Pb+O2=Δ=2PbO(黄色)
Pb+S=Δ=PbS
(2)与非氧化性酸能反应。
Pb+2HCl=PbCl2+H2↑(PbCl2微溶,反应不易进行)
Pb+4HCl(浓)=H2[PbCl4]+H2↑
(3)与强氧化性酸能反应。
Pb+3H2SO4(浓)=Pb(HSO4)2+SO2↑+2H2O
Pb+4HNO3(浓)=Pb(NO3)2+2NO2↑+2H2O
(4)与强碱能反应。
Pb+NaOH+2H2O=Na[Pb(OH)3]+H2↑
2、PbO、PbO2
PbO偏碱性,PbO2偏酸性。
(1)PbO黄色固体,又叫铅黄或密陀僧。
PbO+CO2=PbCO3
PbO+2HCl=Δ=PbCl2+H2O
PbO+2HNO3=Pb(NO3)2+H2O
PbO+NaOH+H2O=Na[Pb(OH)3]
用NaClO氧化[Pb(OH)3]-可得PbO2。
ClO-+[Pb(OH)3]-=PbO2+Cl-+OH-+H2O
在空气中加热,会生成Pb3O4。
6PbO+O2=Δ=2Pb3O4
(2)PbO2,黑色固体,有强氧化性。PbO2固体能导电,可以当电极。
PbO2+4HCl(aq)=PbCl2+Cl2↑+2H2O
5PbO2+2Mn2++4H+=2MnO4-+Pb2++2H2O
PbO2稳定性较差,加热后,生成PbO、Pb3O4(红色,又叫铅丹)、Pb2O3(橙色)等。
3、Pb(OH)2
一般是指PbO的水合物。
3(CH3COO)2Pb+6NaOH=3PbO·H2O↓+6CH3COONa+2H2O
加过量的NaOH时,沉淀溶解。
3PbO·H2O+2H2O+3NaOH=3Na[Pb(OH)3]
4、铅盐
(1)Pb2+
Pb2+遇铬酸根生成黄色沉淀。
Pb2++CrO42-=PbCrO4↓(又叫铬黄)
(2)PbCl2白色固体。在冷水中微溶,溶于热水中,在浓盐酸中也会溶解,易溶于氯化铵、碱金属氢氧化物溶液。
PbCl2+2HCl=H2[PbCl4]
PbCl2+3NaOH=Na[Pb(OH)3]+2NaCl
(3)PbSO4,又叫铅矾,白色固体,难溶于水,溶于热浓硫酸、浓盐酸、浓硝酸、浓碱液、醋酸铵等溶液。
铅蓄电池的总反应:
Pb+PbO2+2H2SO4=2PbSO4+2H2O。
负极反应:Pb-2e-+SO42-=PbSO4。
正极反应:PbO2+2e-+SO42-+4H+=PbSO4+2H2O。
(4)PbS,黑色固体,难溶于水和碱,可溶于硝酸。
PbCO3,白色固体,难溶于水。醋酸铅((CH3COO)2Pb)是弱电解质,易溶于水。
(5)Pb(NO3)2,易溶于水,用于制造其它难溶铅盐。
5、应用
铅用于制造蓄电池、电缆、子弹和弹药等,用于制造化工和冶金设备,还用于制造核电站屏蔽和核废料贮罐。铅合金用作轴承、活字金和焊料等。铅化合物用作颜料、玻璃、塑料和橡胶的原料,也是汽油的添加剂。
6、铅的制取
方铅矿先在空气中焙烧,再用碳还原。
2PbS+3O2=焙烧=2PbO+2SO2
PbO+C=Δ=Pb+CO↑
五、铀92U
钙铀云母
铀是自然界中能够找到的最重的原生元素。在自然界中存在233U、235U、238U三种同位素。铀化合物早期用于瓷器的着色,在核裂变现象被发现后用作为核燃料。
铀的化学性质很活泼,自然界不存在游离态的金属铀,它以化合状态存在着。有沥青铀矿和钾钒铀矿两种常见的矿床。
核外价电子排布为5f36d17s2,价态有+3、+4、+5、+6,以+4和+6为主。
1、金属铀,银白色,熔点1132.3℃,沸点3818℃,硬度强、密度高、可延展、有放射性等特征。铀及其化合物均有较大的化学毒性。
(1)与几乎所有非金属元素(惰性气体除外)反应生成化合物,常以U3+、U4+、UO2+和UO22+离子形式存在。
在空气中加热就燃烧,也能自燃。
U+O2=点燃=UO2
铀与氢在250℃时发生可逆反应,生成UH3。
2U+3H2⇌250℃⇌2UH3
与水、酸都能反应。
U+8HNO3=UO2(NO3)2+6NO2↑+4H2O
铀能与许多金属反应生成金属间化合物。铀可与铌、铪、锆、钼及钛生成固溶体。
2、UO2、UO3
(1)二氧化铀UO2,红棕色晶体,它是动力反应堆中广泛使用的核燃料,又是干法制备四氟化铀的重要原料。
碱性氧化物,在强酸中易溶,硝酸能将它氧化为硝酸铀酰UO2(NO3)2。
UO2+2H2SO4=U(SO4)2+2H2O
UO2+4HNO3=UO2(NO3)2+2NO2↑+2H2O
UO2+4HF=UF4+2H2O
2UO2+O2=500℃以下=2UO3
3UO2+O2=500℃以上=U3O8
(2)三氧化铀UO3,橙红色晶体。两性氧化物,溶于盐酸、硝酸、强碱等。
它在溶液中以UO22+或U2O72-存在,其离子方程式如下:
UO3+2HNO3=UO2(NO3)2+H2O
2UO3+2NaOH=Na2U2O7+H2O
6UO3=Δ=2U3O8+O2↑
(3)八氧化三铀U3O8,最稳定的铀氧化物,它呈橄榄绿色至黑色固体。不溶于水,溶于硝酸和硫酸。
U3O8+4H2SO4=U(SO4)2+2UO2SO4+4H2O
U3O8+8HNO3=3UO2(NO3)2+2NO2↑+4H2O
3、UF4、UF6
(1)四氟化铀UF4,浅翠绿色结晶性粉末,熔点1036℃,沸点1417℃。是铀最重要的化合物之一。可以用以制备六氟化铀和铀。
通过钙(镁)金属热还原法制金属铀:
UF4+2Ca=高温=U+2CaF2
UF4+2Mg=高温=U+2MgF2
与氟气反应制六氟化铀:
UF4+F2=250℃=UF6
与氧气反应制六氟化铀:
2UF4+O2=800℃=UF6+UO2F2。
(2)六氟化铀UF6,熔点64.5~64.8℃(三相点温度),沸点56.4℃。是铀的唯一稳定的气态化合物,为气体扩散法、超离心法分离和富集235U和238U最为适宜的工作介质,广泛用于铀同位素的分离。
化学性质活泼,与水起剧烈反应,与大多数有机化合物起氟化反应,化学腐蚀性强。
UF6+2H2O =4HF+UO2F2
4、UCl4、UCl6
(1)UCl4,深绿色晶体,熔点590℃。沸点792℃。有毒,具放射性和强吸湿性,挥发性高,易溶于水。
置于空气中就被氧化,加热反应更快。
UCl4+O2=300~350℃=UO2Cl2(氯化铀酰)+Cl2
较高温时被氧气氧化为八氧化三铀。
3UCl4+4O2=高温=U3O8+6Cl2
与氯气反应生成UCl5或UCl6。
用将二氧化铀与氯化剂(如亚硫酰氯SOCl2、光气、一氯化硫及四氯化碳等)在适当条件下反应而得。
UO2+2SOCl2=Δ=UCl4+2SO2
(2)UCl6,绿色晶体。固体中含有UCl6分子。熔点177.5℃。溶于四氯化碳、三氯甲烷。
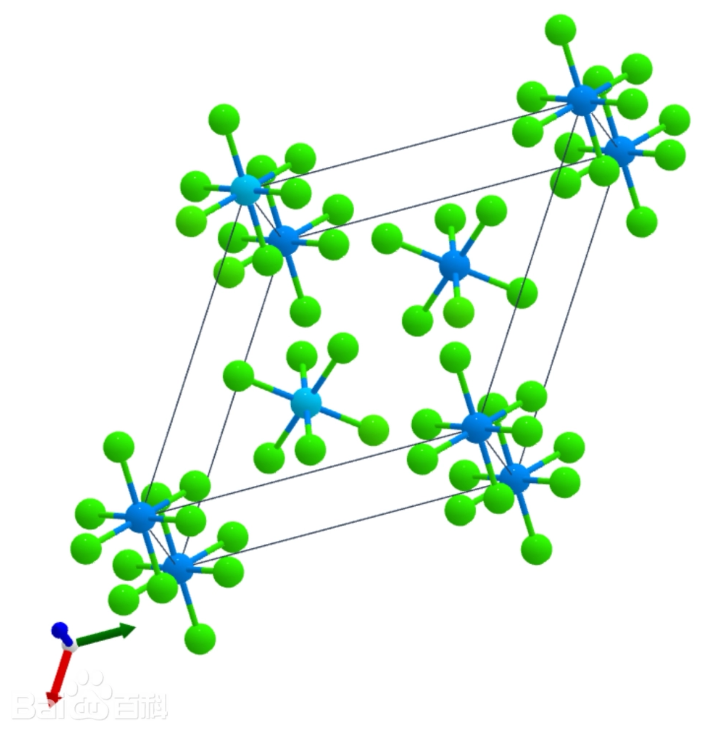
UCl6分子晶胞结构
在潮湿空气中水解。与水剧烈反应生成氯化铀酰(UO2Cl2)。
UCl6+2H2O =4HCl+UO2Cl2
5、硝酸铀酰UO2(NO3)2,也称“硝酸双氧铀”,具放射性。溶于水、醇、醚和丙酮,水溶液成酸性。用作分析试剂,制备铀的化合物等。UO2(NO3)2·6H2O是浅黄绿色晶体。
2UO2(NO3)2=Δ=2UO3+4NO2↑+O2↑
2UO2(NO3)2(aq)+6NH3+3H2O=(NH4)2U2O7↓(重铀酸铵,又叫黄饼)+4NH4NO3
6、陶瓷核燃料
有二氧化铀、碳化铀、氮化铀、硅化铀等。
碳化铀有UC、UC2和U2C33种化合物,其中只有UC可用作核燃料。
氮化铀有UN、UN2和U2N33种化合物,其中只有UN可用作核燃料。
硅化铀有U3Si,U3Si22种化合物,含铀量高的是U3Si,可用作核燃料。
7、原子弹,又叫核弹,是利用铀235或钚239等重原子核裂变反应,瞬时释放出巨大能量的核武器。利用核反应的光热辐射、冲击波和感生放射性造成杀伤和破坏作用,以及造成大面积放射性污染,阻止对方军事行动以达到战略目的的大杀伤力武器。
核裂变,又称核分裂,是指由重的原子核分裂成两个或多个质量较小的原子的一种核反应形式。
8、贫铀弹是利用贫铀合金制造的一种高效燃烧穿甲弹,它借助贫铀材料密度大(铅密度的2倍)、强度大(钢强度的3倍)和穿透力强,且易燃烧的特点制作而成,贫铀弹爆炸后残留的235U等能损害肾脏、神经系统,可导致肺癌等。


- 全部评论(0)
