二氧化碳与盐或碱溶液反应产物的判断
时间:2021-05-03 18:03 来源:未知 作者:化学自习室 点击: 次 所属专题: 二氧化碳与碱 二氧化碳与盐
版权申明:凡是署名为“化学自习室”,意味着未能联系到原作者,请原作者看到后与我联系(邮箱:79248376@qq.com)!
1、CO2与盐溶液反应产物或现象的判断
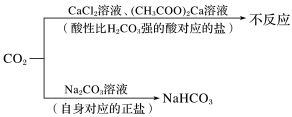
一般从强酸制弱酸的角度去分析。由于碳酸比硅酸、次氯酸、苯酚、Al(OH)3(偏铝酸)的酸性强,因此可用CO2制取上述物质,常涉及的变化如下:
CO2+Na2SiO3+H2O===Na2CO3+H2SiO3↓(或CO2+Na2SiO3+2H2O===H4SiO4↓+Na2CO3)
CO2+Ca(ClO)2+H2O===CaCO3↓+2HClO
CO2+![]() +H2O―→
+H2O―→![]() +NaHCO3
+NaHCO3
CO2(过量)+NaAlO2+2H2O===Al(OH)3↓+NaHCO3
CO2(少量)+2NaAlO2+3H2O===2Al(OH)3↓+Na2CO3
2、CO2与碱溶液反应产物的判断
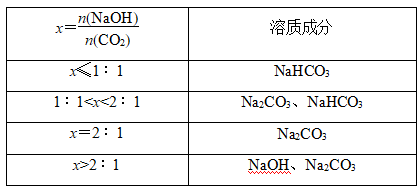
(1)CO2与单一组分反应(如CO2通入NaOH溶液)产物的分析
①反应原理
CO2+2NaOH===Na2CO3+H2O(CO2少量时)
CO2+NaOH===NaHCO3(CO2过量时)
②反应后溶质成分的判断
③用数轴来表示
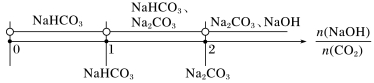
(2)CO2与多组分[如CO2通入NaOH、Ca(OH)2的混合溶液]反应的顺序:
①Ca(OH)2+CO2===CaCO3↓+H2O
②2NaOH+CO2===Na2CO3+H2O
③Na2CO3+CO2+H2O===2NaHCO3
④CaCO3+CO2+H2O===Ca(HCO3)2
![]()
1.用四种溶液进行实验,下表中“操作及现象”与“溶液”对应关系错误的是( )
| 选项 | 操作及现象 | 溶液 |
A | 通入CO2,溶液变浑浊 | 饱和Na2CO3溶液 |
B | 通入CO2,溶液变浑浊,继续通CO2至过量,浑浊消失 | Na2SiO3溶液 |
C | 通入CO2,溶液变浑浊,再加入品红溶液,红色褪去 | Ca(ClO)2溶液 |
D | 通入CO2,溶液变浑浊,继续通CO2至过量,浑浊消失,再加入足量NaOH溶液,又变浑浊 | 澄清石灰水 |
答案 B
解析 由于相同温度下Na2CO3的溶解度大于NaHCO3的溶解度,因而会析出NaHCO3晶体,A项正确;H2SiO3与CO2不反应,浑浊不会消失,B项错误;CO2+Ca(ClO)2+H2O===CaCO3↓+2HClO,溶液变浑浊后加入品红溶液,被HClO氧化褪色,C项正确。
2.标准状况下,将3.36 L CO2气体通入200 mL 1.00 mol·L-1NaOH溶液中,充分反应后溶液中c(CO32-)与c(HCO3-)的比值为(不考虑CO32-、HCO3-的水解)( )
A.1∶1 B.1∶2 C.2∶1 D.1∶3
答案 B
解析 n(CO2)=33.6L÷22.4 L·mol-1=0.150 mol,n(NaOH)=0.200 L×1.00 mol·L-1=0.200 mol,
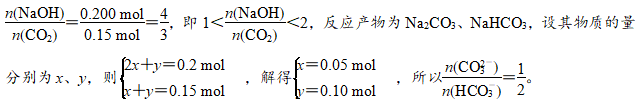
3.(2020·吉林模拟)将足量CO2通入KOH和Ca(OH)2的混合稀溶液中,生成沉淀的物质的量(N)和通入CO2体积(V)的关系正确的是( )
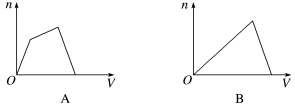
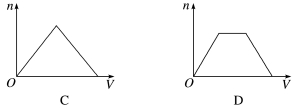
答案 D
解析 CO2与KOH和Ca(OH)2都会反应,但存在着竞争,如果先与KOH反应,则反应后生成的K2CO3立即会与Ca(OH)2反应生成CaCO3,因此,可以看成CO2先与Ca(OH)2反应,所以通CO2后立即有CaCO3生成。第二步还要判断CO2是先跟KOH反应还是先与生成的CaCO3反应,同样可以采用假设法判断,即如果先与CaCO3反应,则生成的Ca(HCO3)2又会与KOH反应,因此是先与KOH反应,此过程生成沉淀的物质的量不变,当KOH反应完全,CO2再与CaCO3反应,直至沉淀完全溶解,故选D。

- 全部评论(0)
