如何判断原子半径和离子半径的大小
时间:2021-06-30 08:38 来源:未知 作者:化学自习室 点击: 次 所属专题: 半径比较
版权申明:凡是署名为“化学自习室”,意味着未能联系到原作者,请原作者看到后与我联系(邮箱:79248376@qq.com)!
原子半径或离于半径的大小,与其电子层数、核电荷数及核外电子数有关。
在中学化学里主要比较主族元素和短周期元素的原子半径、离子半径的大小,尽量其中有一定的规律性,但也有一些例外情况,因此只能说是大致的规律。
(1)同周期元素的原子半径
同周期元素的原子,从左到右随核电荷数的递增,原子半径逐渐减小(稀有气体元素的原子除外)。如第3周期中各元素原子半径的大小为:Na>Mg>Al>Si>P>S>Cl。
(2)同主族元素的原子半径
同主族元素的原子半径,从上到下随核电荷数的递增,电子层数增多,原子半径逐渐增大。如碱金属元素的原子半径大小为:Li<Na<K<Rb<Cs;卤族元素的原子半径大小为:F<Cl<Br<I。
(3)同种元素的原子半径与它形成的相应离子半径的大小比较
同种元素的原子与它形成的相应离子半径的大小比较,有两种情况:
①阳离子半径小于相应的原子半径。如Na+离子半径小于Na原子半径,Mg2+离子半径小于Mg原子半径。这是因为阳离子比相应的原子少了一个电子层。
②阴离子半径远大于相应的原子半径。如Cl-离子半径远大于Cl原子半径,S2-离子半径远大于S原子半径。这是因为阴离子与相应的原子电子层数相同,但阴离子最外电子层上的电子数已达稳定结构,比相应原子最外电子层上的电子数要多。
(4)相同元素的原子显示不同价态(共价)时,价态越高其原子半径越小。如H2SO4分子中S原子的半径小于H2SO3分子中S原子的半径。
(5)同主族元素形成的离子,从上到下随核电荷数的增加,电子层数增多,离子半径逐渐增大。如碱金属元素形成的阳离子半径大小为:Li+<Na+<K+<Rb+<Cs+;卤族元素形成的阴离子半径大小为:F-<Cl-<Br-<I-。
(6)同周期元素形成的离子,比较其半径大小时应分成两段分别进行。
①同周期元素形成的阳离子,从左到右随核电荷数的递增,阳离子半径逐渐减小。如第3周期中阳离子半径的大小为:Na+>Mg2+>Al3+。
②同周期元素形成的阴离子,从左到右随核电荷数的递增,阴离子半径逐渐减小。如第3周期中阴离子半径的大小为:S2->Cl-。
必须注意到,同一周期中的阳离子半径均小于同周期的阴离子半径。
(7)核外电子排布相同的离子(不管是阳离子还是阴离子),随核电荷数的增大,其离子半径逐渐减小。如第2周期中的阴离子与第3周期中的阳离子,其核外电子排布相同,这些离子半径的大小为:O2->F->Na+>Mg2+>Al3+。
(8)同一元素形成的带不同电荷的阳离子,所带电荷数多的离子半径小。如Fe3+离子半径小于Fe2+离子半径。
(9)常见短周期元素的离子中,以H+离子半径为最小。其它常见离子半径的大小,可归纳成下表:
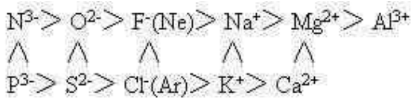
表中所列Ne、Ar是为了比较时便于划分周期,它们左边的离子是与它们同周期元素的离子,它们的右边的离子是它们下一周期元素的离子。同一横行中的离子核外电子排布相同,下边一横行比上边一横行多一个电子层。Ne、Ar原子半径特殊,不在比较之列。表中所列F-与K+离子的半径大小差不多。N3-、P3-只存在于干态,如Mg3N2、Ca3P2在水里立即与水反应,由离子态转化为共价态:
Mg3N2+6H2O====3Mg(OH)2+2NH3↑
Ca3P2+6H2O====3Ca(OH)2+2PH3↑
O2-也不能存在于水溶液里,它与水反应生成OH-,由此可知Na2O、K2O、BaO、CaO与水完全反应生成碱溶液。

- 全部评论(0)
