区分极性分子和非极性分子的几种方法
时间:2016-01-30 12:47 来源:未知 作者:李耀军 点击:次 所属专题: 分子极性
版权申明:凡是署名为“化学自习室”,意味着未能联系到原作者,请原作者看到后与我联系(邮箱:79248376@qq.com)!
1、中心原子化合价法:
组成为ABn型化合物,若中心原子A的化合价等于族的序数,则该化合物为非极性分子.如:CH4,CCl4,SO3,PCl5
2、受力分析法:
若已知键角(或空间结构),可进行受力分析,合力为0者为非极性分子.如:CO2,C2H4,BF3
3、非极性分子:同种原子组成的双原子分子都是非极性分子。
4、简单判断方法
高中阶段常见的分子极性:
极性分子:HX,CO,NO,H2O,H2S,NO2,SO2,SCl2,NH3,H2O2,CH3Cl,CH2Cl2,CHCl3,CH3CH2OH
非极性分子:Cl2,H2,O2,N2,CO2,CS2,BF3,P4,C2H2,SO3,CH4,CCl4,SiF4,C2H4,C6H6,PCl5,汽油
总结:键的极性与分子的极性的区别与联系
概念 | 键的极性 | 分子的极性 |
含义 | 极性键和非极性键 | 极性分子和非极性分子 |
决定因素 | 是否由同种元素原子形成 | 极性分子和非极性分子 |
联系 | 1. 以非极性键结合的双原子分子必为非极性分子; 2. 以极性键结合的双原子分子一定是极性分子; 3. 以极性键结合的多原子分子,是否是极性分子, 由该分子的空间构型决定。 | |
说明 | 键有极性,分子不一定有极性。 | |
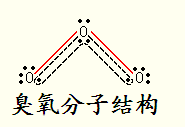
注: 臭氧是已发现的唯一一种极性单质分子,与SO2的结构类似。中心氧原子与边上两个氧原子通过两个非极性单键和一个三中心四电子的π键结合,可认为中心氧原子为+2/3价,边上两个氧原子分别为-1/3价

- 全部评论(0)
(979249414) 评论 区分极性分子和非极性分子:谢谢,很有用,非常准确
(1482516534) 评论 区分极性分子和非极性分子:真的太全啦/有帮助的呀
(1482516534) 评论 区分极性分子和非极性分子:真的太全啦/有帮助的呀
