常见气体的制取和检验
时间:2021-08-17 18:23 来源:未知 作者:化学自习室 点击: 次 所属专题: 气体制备
版权申明:凡是署名为“化学自习室”,意味着未能联系到原作者,请原作者看到后与我联系(邮箱:79248376@qq.com)!
(1)氧气
制取原理——含氧化合物自身分解
制取方程式——2KClO3 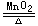 2KCl+3O2↑
2KCl+3O2↑
装置——略微向下倾斜的大试管,加热
检验——带火星木条,复燃
收集——排水法或向上排气法
(2)氢气
制取原理——活泼金属与弱氧化性酸的置换
制取方程式——Zn+H2SO4 === H2SO4+H2↑
装置——启普发生器
检验——点燃,淡蓝色火焰,在容器壁上有水珠
收集——排水法或向下排气法
(3)氯气
制取原理——强氧化剂氧化含氧化合物
制取方程式——MnO2+4HCl(浓) MnCl2+Cl2↑+2H2O
MnCl2+Cl2↑+2H2O
装置——分液漏斗,圆底烧瓶,加热
检验——能使湿润的蓝色石蕊试纸先变红后褪色;
除杂质——先通入饱和食盐水(除HCl),再通入浓H2SO4(除水蒸气)
收集——排饱和食盐水法或向上排气法
尾气回收——Cl2+2NaOH=== NaCl+NaClO+H2O
(4)硫化氢
①制取原理——强酸与强碱的复分解反应
②制取方程式——FeS+2HCl=== FeCl2+H2S↑
③装置——启普发生器
④检验——能使湿润的醋酸铅试纸变黑
⑤除杂质——先通入饱和NaHS溶液(除HCl),再通入固体CaCl2(或P2O5)(除水蒸气)
⑥收集——向上排气法
⑦尾气回收——H2S+2NaOH=== Na2S+H2O或H2S+NaOH=== NaHS+H2O
(5)二氧化硫
①制取原理——稳定性强酸与不稳定性弱酸盐的复分解
②制取方程式——Na2SO3+H2SO4=== Na2SO4+SO2↑+H2O
③装置——分液漏斗,圆底烧瓶
④检验——先通入品红试液,褪色,后加热又恢复原红色;
⑤除杂质——通入浓H2SO4(除水蒸气)
⑥收集——向上排气法
⑦尾气回收——SO2+2NaOH=== Na2SO3+H2O
(6)二氧化碳
①制取原理——稳定性强酸与不稳定性弱酸盐的复分解
②制取方程式——CaCO3+2HCl==CaCl2+CO2↑+H2O
③装置——启普发生器
④检验——通入澄清石灰水,变浑浊
⑤除杂质——通入饱和NaHCO3溶液(除HCl),再通入浓H2SO4(除水蒸气)
⑥收集——排水法或向上排气法
(7)氨气
①制取原理——固体铵盐与固体强碱的复分解
②制取方程式——Ca(OH)2+2NH4Cl CaCl2+NH3↑+2H2O
CaCl2+NH3↑+2H2O
③装置——略微向下倾斜的大试管,加热
④检验——湿润的红色石蕊试纸,变蓝
⑤除杂质——通入碱石灰(除水蒸气)
⑥收集——向下排气法
(8)氯化氢
①制取原理——高沸点酸与金属氯化物的复分解
②制取方程式——NaCl+H2SO4 Na2SO4+2HCl↑
Na2SO4+2HCl↑
③装置——分液漏斗,圆底烧瓶,加热
④检验——通入AgNO3溶液,产生白色沉淀,再加稀HNO3沉淀不溶
⑤除杂质——通入浓硫酸(除水蒸气)
⑥收集——向上排气法
(9)二氧化氮
①制取原理——不活泼金属与浓硝酸的氧化—还原;
②制取方程式—Cu+4HNO3(浓)===Cu(NO3)2+2NO2↑+2H2O
③装置——分液漏斗,圆底烧瓶(或用大试管,锥形瓶)
④检验——红棕色气体,通入AgNO3溶液颜色变浅,但无沉淀生成
⑤收集——向上排气法
⑥尾气处理——3NO2+H2O===2HNO3+NO;NO+NO2+2NaOH===2NaNO2+H2O
(10)一氧化氮
①制取原理——不活泼金属与稀硝酸的氧化—还原;
②制取方程式——Cu+8HNO3(稀)===3Cu(NO3)2+2NO↑+4H2O
③装置——分液漏斗,圆底烧瓶(或用大试管,锥形瓶)
④检验——无色气体,暴露于空气中立即变红棕色
⑤收集——排水法
(11)一氧化碳
①制取原理——浓硫酸对有机物的脱水作用
②制取方程式——HCOOH CO↑+H2O
CO↑+H2O
③装置——分液漏斗,圆底烧瓶
④检验——燃烧,蓝色火焰,无水珠,产生气体能使澄清石灰水变浑浊
⑤除杂质——通入浓硫酸(除水蒸气)
⑥收集——排水法
(12)甲烷
①制取方程式——CH3COONa+NaOH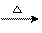 CH4↑+Na2CO3
CH4↑+Na2CO3
②装置——略微向下倾斜的大试管,加热
③收集——排水法或向下排空气法
(13)乙烯
①制取原理——浓硫酸对有机物的脱水作用
②制取方程式——CH3CH2OH  CH2=CH2↑+H2O
CH2=CH2↑+H2O
③装置——分液漏斗,圆底烧瓶,加热
④除杂质——通入NaOH溶液(除SO2,CO2),通入浓硫酸(除水蒸气)
⑤收集——排水法
(14)乙炔
①制取原理——电石强烈吸水作用
②制取方程式——CaC2+2H2O Ca(OH)2+CH CH↑
Ca(OH)2+CH CH↑
③装置——分液漏斗,圆底烧瓶(或用大试管,锥形瓶)
④检验——无色气体,能燃烧,产生明亮的火焰,并冒出浓的黑烟
⑤除杂质——通入硫酸铜溶液(除H2S,PH3),通入浓硫酸(除水蒸气)
⑥收集——排水法或向下排气法
(15)硝酸
实验室制法:2NaNO3+H2SO4 Na2SO4+HNO3↑
Na2SO4+HNO3↑
工业制法:一氧化氮与水反应。
检验硝酸根:棕色环[Fe(NO)(H2O)5]2+
(16)三氧化硫
制取:五氧化二磷夺取浓硫酸中的水分。使三氧化硫逸出。
再根据三氧化硫的熔点低。进行冷凝。得到固体。

- 全部评论(0)
