11种常见气体的制备
时间:2023-08-13 10:36 来源:未知 作者:化学自习室 点击: 次 所属专题: 气体制备
版权申明:凡是署名为“化学自习室”,意味着未能联系到原作者,请原作者看到后与我联系(邮箱:79248376@qq.com)!
一、氯气的实验室设备
1、反应原理
MnO2+4HCl(浓) MnCl2+Cl2↑+2H2O
MnCl2+Cl2↑+2H2O
2、氯气实验室制法的本质
(1)若无浓盐酸,可用NaCl和浓H2SO4代替:
MnO2+2NaCl+3H2SO4(浓) MnSO4+2NaHSO4+Cl2↑+2H2O。
MnSO4+2NaHSO4+Cl2↑+2H2O。
(2)反应物若无MnO2,可用其他强氧化剂如KClO3、Ca(ClO)2、KMnO4等代替:
①KClO3+6HCl(浓)=KCl+3Cl2↑+3H2O
②Ca(ClO)2+4HCl(浓)= CaCl2+2Cl2↑+2H2O
③2KMnO4+16HCl(浓)=2KCl+2MnCl2+5Cl2↑+8H2O
3、实验装置
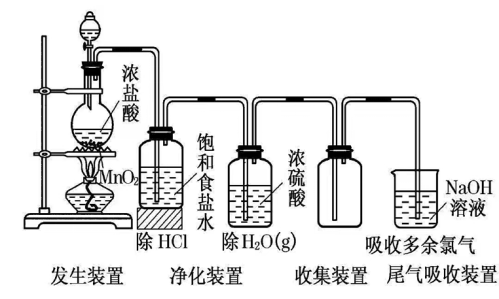
(1)发生装置:由分液漏斗、圆底烧瓶等组装的固液加热型制气装置。
(2)净化装置:饱和食盐水除去Cl2中的HCl气体,浓硫酸除去Cl2中的水蒸气,也可用干燥的氯化钙,装置如图:
(3)收集装置:向上排空气法或排饱和食盐水法。
(4)尾气处理:用 NaOH溶液吸收多余的Cl2,以防Cl2污染空气。
4、验满方法
(1)将湿润的淀粉−碘化钾试纸靠近收集Cl2的集气瓶瓶口,若观察到试纸立即变蓝,则证明已收集满。
(2)将湿润的蓝色石蕊试纸靠近盛氯气的瓶口,若观察到试纸先变红后褪色,则证明已收集满。
(3)根据氯气的颜色判断是否收集满:若观察到整个集气瓶中充满黄绿色的气体,则证明已收集满。
(4)将蘸有浓氨水的玻璃棒至于管口,若产生白烟,这证明已收集满
5、实验室制取氯气的注意事项
(1)为了减少制得的Cl2中HCl的含量,加热时温度不宜过高,以减少HCl的挥发。
(2)制取时一定要注意反应条件是“浓盐酸”和“加热”,一旦浓盐酸变为稀盐酸,反应将不再发生。
(3)尾气吸收时,不能用澄清石灰水吸收Cl2,因为澄清石灰水中Ca(OH)2浓度小,吸收不完全,工业上常采用石灰乳来吸收Cl2
(4)实验结束后,先使反应停止并排出装置中残留的Cl2,再拆卸装置,避免污染空气
二、氨气的实验室设备
 1、用铵盐和碱制取
1、用铵盐和碱制取
(1)反应原理:
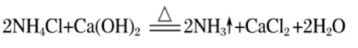
(2)实验装置
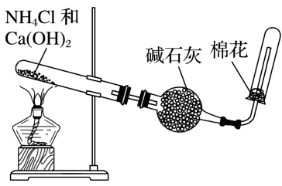
①发生装置:用试管(略向下倾斜)等组装的固体加热型制气装置。
②净化装置:用碱石灰干燥
③收集装置:向下排空气法
④尾气处理:在试管口塞一团用硫酸浸湿过的棉花球,用于吸收氨气,防止氨气逸出,污染大气,由于氨气易溶于水所以多余气体吸收时要防止倒吸,常采用装置有:
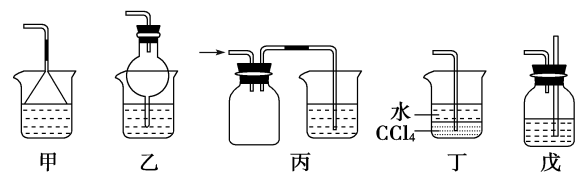
2、用浓氨水制取
(1)反应原理
①加热浓氨水:NH3·H2O NH3↑+H2O
NH3↑+H2O
②浓氨水+固体氢氧化钠:氢氧化钠溶于水放热,促进一水合氨的分解,且氢氧根浓度增大有利于氨气的逸出
③浓氨水+固体CaO:CaO与水反应,使溶剂(水)减少;反应放热,促使NH3·H2O分解,NH3逸出:NH3·H2O+CaO=NH3↑+ Ca(OH)2[来源:ZXK.COM][来源)
(2)实验装置——发生装置
①加热浓氨水
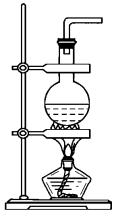
②浓氨水+固体氢氧化钠/浓氨水+固体CaO
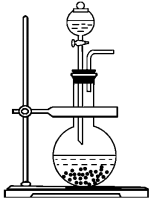
3、验满方法
(1)用湿润的红色石蕊试纸至于试管口,试纸由红色变为蓝色
(2)将蘸有浓盐酸的玻璃棒至于试管口,试管口处有白烟产生
4、注意事项
(1)不能用硝酸铵与氢氧化钙反应生成氨。
加热时产生NH3和HNO3,随着温度的升高,硝酸的强氧化作用起作用,进一步将生成的氨氧化成氮气和氮氧化物,因此不能利用NH4NO3与Ca(OH)2反应生成氨。
(2)实验室不能用氢氧化钠和氢氧化钾代替氢氧化钙。
因为NaOH和KOH都是强碱,具有吸湿性(潮解性),容易结块,所以不容易与铵盐混合进行充分接触反应,氢氧化钾和氢氧化钠具有很强的腐蚀性,加热时会腐蚀玻璃仪器。
(3)用试管收集氨气要堵棉花。
因为NH3分子微粒直径小,易与空气发生对流,堵棉花目的是防止氨气与空气对流,确保收集纯净;减少NH3对空气的污染。
(4)实验室制NH3除水蒸气用碱石灰,而不采用浓硫酸和氯化钙固体。
因为浓硫酸会与氨气反应;氨气与氯化钙能发生络合反应,生成络合物。
(5)收集装置和反应装置的试管和导管必须是干燥的。
(6)发生装置的试管口略向下倾斜。
(7)由于氨气的密度比空气小,因此收集氨气时,导管应插入接近试管的底部。
三、乙烯的实验室制取
1、制取原理CH3CH3OH CH2=CH2↑+H2O
CH2=CH2↑+H2O
2、实验装置(B为氢氧化钠溶液)
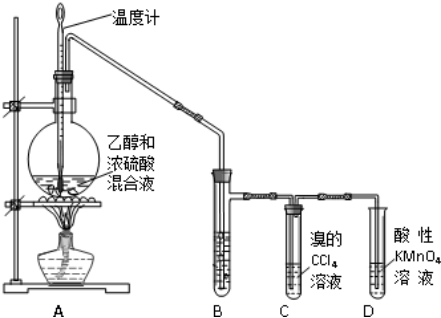
(1)发生装置:用分液漏斗、圆底烧瓶以及温度计等组装的固液加热型制气装置。
(2)净化装置:用盛有氢氧化钠的试管吸收硫酸碳化生成的二氧化硫,二氧化碳等杂质
(3)收集装置:乙烯的密度与空气相当,所以不能用排空气取气法,只能排水法收集
(4)尾气处理:将乙烯通入到足量溴水中,至溴水不再变色。
3、乙烯的检验方法
(1)与酸性高锰酸钾溶液反应

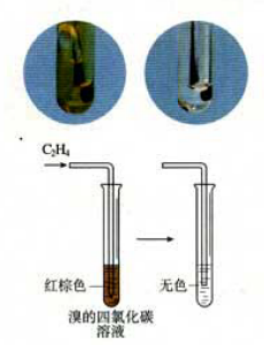
酸性高锰酸钾溶液褪色,说明乙烯比较活泼,易被强氧化剂氧化,乙烯能被酸性KMnO4溶液氧化为CO2。
(2)乙烯的加成反应
有机物分子中的不饱和碳原子与其他原子或原子团直接结合生成新的化合物的反应叫加成反应:CH2=CH2+Br2→CH2BrCH2Br (将乙烯通入溴水中,溴水褪色)
注:乙烯使溴的四氯化碳溶液褪色与使酸性KMnO4溶液褪色的原理不同,前者发生的是加成反应,后者发生的是氧化还原反应。
4、注意事项
(1)浓硫酸起催化剂和脱水剂的作用,加沸石或碎瓷片的作用是防止反应混合物受热暴沸
(2)浓硫酸与乙醇按了3:1的体积比混合,浓硫酸过量的原因是促使反应向正反应方向进行
(3)温度要迅速上升至170°C,防止在140°C时生成副产物乙醚。此反应属于取代反应而非消去反应
(4)制乙烯时反应溶液变黑的原因是乙醇与浓硫酸发生了氧化还原反应,所以,实验室制取的乙烯中还可能混有CO₂、SO₂等杂质气体
5、乙烯的来源和用途
(1)乙烯的来源
从石油中获得乙烯,已成为目前工业上生产乙烯的主要途径。乙烯是石油的裂解产物,乙烯的产量可以用来衡量一个国家的石油化工发展水平。
(2)乙烯的用途
①乙烯是重要的化工原料,可用来制造聚乙烯塑料、聚乙烯纤维、乙醇等。
②在农业生产中,可用作植物生长调节剂和催熟剂。
四、乙炔的实验室制备
1、反应原理:
CaC2+2H2O→Ca(OH)2+CH≡CH↑
2、实验装置
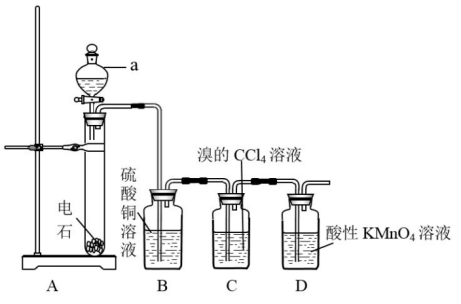
(1)发生装置:用分液漏斗、试管(或锥形瓶)等组装的固液不加热型制气装置。
(2)净化装置:用盛有硫酸铜的试管除去因电石中含有的pH₃、H₂S等杂质
(3)收集装置:实验室制完乙炔用向下排水集气法收集乙炔,要用饱和食盐水,因为如果用蒸馏水,则反应过快,生成的乙炔容易爆炸,饱和食盐水中的水少,所以比较安全。
3、实验操作及现象
实验操作 | 实验现象 |
如图,在圆底烧瓶中放入几小块电石。旋开分液漏斗的活塞,逐滴加入饱和食盐水 | 剧烈反应并产生大量气泡 |
将纯净的乙炔通入盛有酸性高锰酸钾溶液的试管中 | 溶液褪色 |
将纯净的乙炔通入盛有溴的四氯化碳溶液的试管中 | 溶液褪色 |
点燃验纯后的乙炔 | 火焰明亮并伴有浓烟 |
4、注意事项
(1)因电石与水反应很剧烈,应选用分液漏斗,以便控制水的滴加速度。
(2)实验装置在使用前,要先检查装置气密性。
(3)盛电石的试剂瓶要及时密封并放于干燥处,严防电石吸水而失效。取电石要用镊子夹取,严禁用手拿。
(4)为了减缓电石与水的反应速率,实验时常滴加饱和食盐水而不直接滴加水。
(5)因反应剧烈且产生气泡,为防止产生的泡沫进入导管,应在导气管口塞入少许棉花。
(6)纯净的乙炔气体是无色无味的气体。用电石和水反应制取乙炔,常闻到有恶臭气味,是因为电石中含有的少量硫化钙、砷化钙、磷化钙等杂质跟水作用时生成的H2S、AsH3、PH3等气体有特殊气味所致。将混合气体通过盛有氢氧化钠溶液或硫酸铜溶液的洗气瓶可将杂质除去。
五、氧气的实验室制备
1、反应原理
(1)加热氯酸钾制取氧气:

(2)加热高锰酸钾制取氧气:

(3)分解过氧化氢制取氧气:
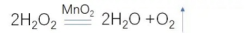
2、实验装置
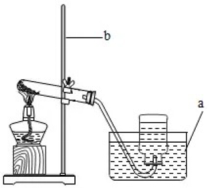
(1)加热氯酸钾制取氧气:
(2)加热高锰酸钾制取氧气:
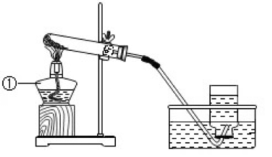
①发生装置:用试管(略向下倾斜),酒精灯,棉花等组装的固体加热型制气装置。
②收集装置:排水法收集
(3)分解过氧化氢制取氧气:
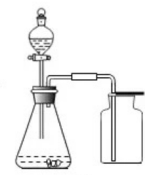
①发生装置:用锥形瓶,分液漏斗等组装的固液不加热型制气装置。
②收集装置:向上排空气法
3、实验步骤
(1)检查装置的气密性
(2)将药品装入试管
(3)将试管固定在铁架台上
(4)点燃酒精灯
(5)收集气体
(5)收集气体完毕,将导管撤离水槽
(6)熄灭酒精灯
4、气体的验满方法:
用向上排空法收集氧气时,将带火星的木条放在集气瓶口,如果木条复燃,说明氧气已收集满。
5、注意事项
(1)固定装置时试管口要略向下倾斜。
(2)加热时先使试管均匀受热,再集中在药品部位加热。
(3)用高锰酸钾制氧气时,试管口要放一小团棉花,防止加热时高锰酸钾颗粒随气体进入导管,甚至堵塞导气管。
(4)用排水法收集氧气完毕时,要先撤水槽中的导管,再熄灭酒精灯。
(5)当气泡连续并均匀的冒出时,此时则证明已开始收集氧气
六、硫化氢的实验室制备
1、实验原理
(1)硫化亚铁与稀硫酸反应:
![]()
(2)硫化亚铁与稀盐酸反应:
![]()
2、实验装置
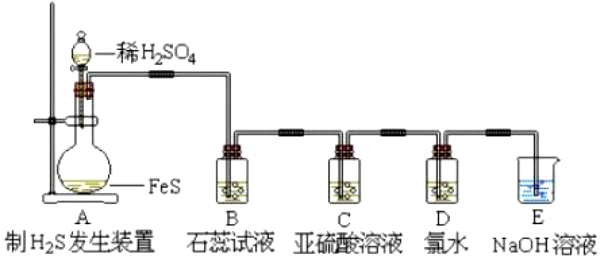
(1)发生装置:用分液漏斗、圆底烧瓶等组装的液液不加热型制气装置。
(2)收集装置:向上排空气法或排饱和硫氢化钠溶液法。
(3)检验装置:石蕊溶液检验硫化氢的酸性;亚硫酸,氯水检验硫化氢的还原性
(4)尾气处理:用 NaOH溶液或硫酸铜吸收多余的硫化氢气体,以防硫化氢污染空气。
3、验满方法
用向上排空法收集硫化氢时,将带燃烧的木条放在集气瓶口,如果木条熄灭,说明硫化氢已收集满。
4、注意事项
(1)所用硫化亚铁应是新购置的,存放时间过久,FeS中Fe和S都会被氧化,从而影响实验效果。
(2)放入气体发生器中的硫化亚铁要砸成蚕豆粒大小的块状。
(3)不能用浓盐酸,因浓盐酸挥发出氯化氢,使硫化氢不纯。
(4)不能用硝酸或浓硫酸,因为它们都是氧化性酸,与FeS发生氧化还原反应,而不能生成硫化氢
(5)硫化氢有毒,实验时应注意通风,多余的硫化氢应及时通入NaOH溶液(或金属盐溶液)中进行吸收。实验结束后,先使反应停止并排出装置中残留的H2S,再拆卸装置,避免污染空气
(6)不易用强氧化性酸如浓硫酸或硝酸制硫化氢,因这些强氧化性酸可将硫化氢
氧化、析出硫单质。
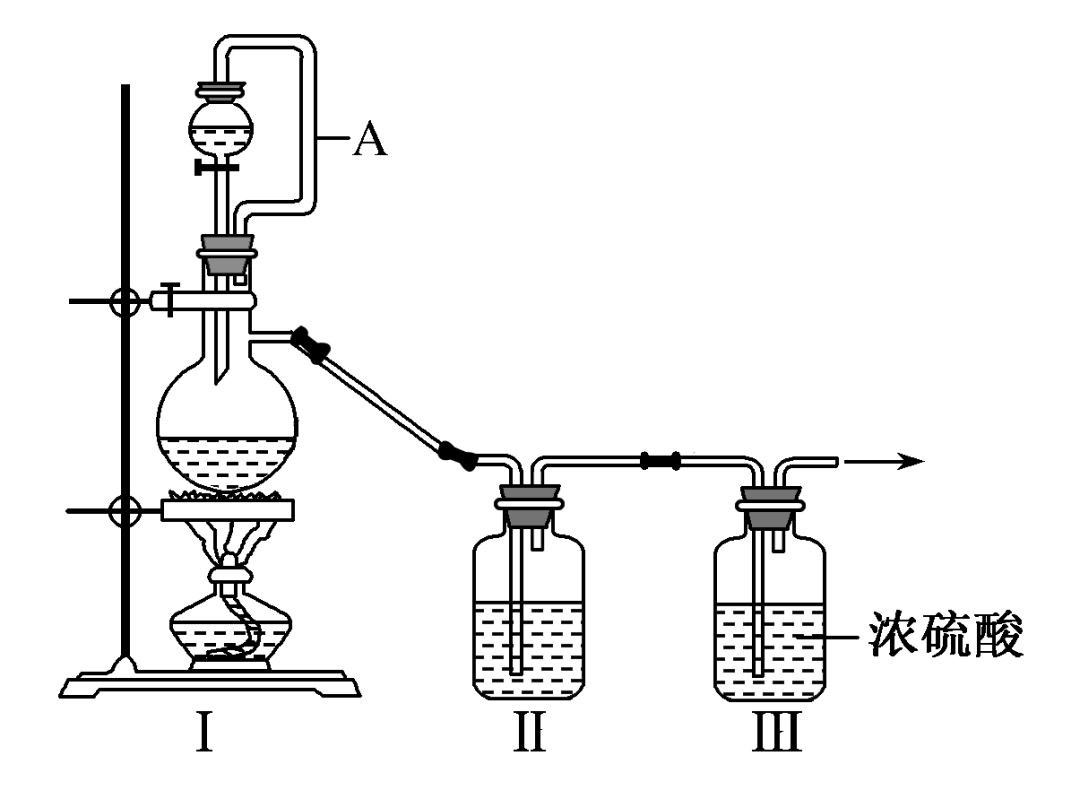
七、二氧化硫的实验室制备
1、实验原理:

2、实验装置:

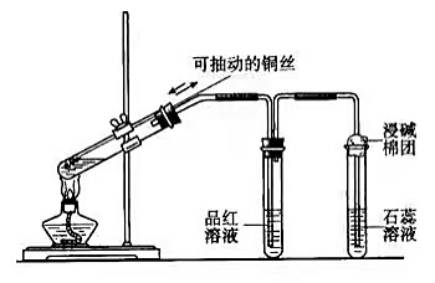
(1)发生装置:
①用分液漏斗、圆底烧瓶组装的固液加热型制气装置
②铜(可抽动铜丝,可随时控制反应发生和停止)与浓硫酸加热
(2)净化装置:盛有浓硫酸的试管,干燥除水蒸气
(3)收集方法:向上排空气法或排饱和亚硫酸氢钠溶液法
(4)尾气处理装置:用强碱溶液吸收多于二氧化硫,防止污染空气
3、检验方法
(1)漂白性:先通入品红试液,褪色,加热后又恢复原红色
(2)还原性:将气体通入稀氯水中,使氯水褪色;将气体通入稀溴水中,使溴水褪色;将气体通入酸性高锰酸钾溶液中,酸性高锰酸钾溶液褪色;将气体通入氯化铁溶液中,氯化铁溶液由黄色变成浅绿色;将气体通入硝酸钡溶液中,产生沉淀。
(3)氧化性:通入氢硫酸,发生归中反应,产生黄色S沉淀
注:SO2和CO2都可使澄清的石灰水变浑浊,检验二者同时存在的一般流程为
| 流程设计 | 检验SO2⇒除去SO2⇒检验SO2是否除尽⇒检验CO2 | |||
选用试剂 | 品红溶液 | 酸性KMnO4溶液 | 品红溶液 | 澄清的石灰水 |
预期现象 | 褪色 | 褪色 | 不褪色 | 变浑浊 |
4、验满方法:用玻璃棒蘸氨水放在瓶口,如果出现浓厚的白烟,表示二氧化硫已收集满
5、注意事项
(1)由于二氧化硫极易溶于水,所以实验室制取二氧化硫的过程中,应用浓硫酸和固体
Na2SO4作为反应物,减少二氧化硫的损耗。
(2)不可用浓盐酸代替浓硫酸,因为其中含有大量的水(常温常压下,质量分数最大的浓盐酸为45%的浓盐酸),否则会有大量的SO2溶解在水中,使产量减少。
(3)实验结束后应先排净装置中残留的二氧化硫,再拆除装置,防止残留的二氧化硫进入到空气中,造成污染。
八、二氧化碳的实验室制备
1、反应原理:
![]()
2、实验装置:
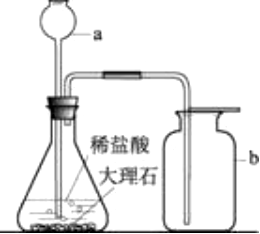
(1)发生装置:用分液漏斗、锥形瓶瓶组装的固液不加热型制气装置
(2)净化装置:通入饱和NaHCO3溶液(除HCl),再通入浓H2SO4(除水蒸气)
(3)收集装置:向上排空气法或排饱和碳酸氢钠溶液法
(4)尾气处理装置:用强碱溶液吸收多余CO2
3、检验方法
(1)将产生气体通入澄清的石灰水,若石灰水变浑浊说明是二氧化碳Ca(OH)2+CO2==CaCO3↓+H2O
(2)将产生的气体通入到紫色石蕊溶液中,若溶液变红,则为二氧化碳
4、验满方法:将燃烧着的小木条放在集气瓶口处,若木条熄灭,则证明已经集满
5、注意事项
(1)稀盐酸应从长颈漏斗加入,长颈漏斗的下端管口要伸入液面以下,防止反应生成的气体从长颈漏斗逸出
(2)不能用酒精灯加热制CO2
(3)不可用稀硫酸和大理石或石灰石反应,会生成微溶性固体硫酸钙,它覆盖在大理石或石灰石表面,阻止反应的进行
(4)不可用硝酸与大理石或石灰石反应,由于硝酸是一种不稳定性的酸,在见光或受热时易分解,从而使制得的CO2,中混有NO2和O2等杂质。
(5)不易用浓盐酸和大理石或石灰石反应,由于浓盐酸具有挥发性,使制得的CO2中混有较多的氯化氢气体,可用饱和碳酸氢钠溶液除去
九、二氧化氮的实验室制备
1、反应原理
Cu+4HNO3(浓)=Cu(NO3)2+2NO2↑+2H2O
2、实验装置
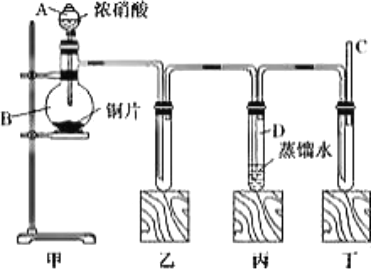
(1)发生装置:分液漏斗、圆底烧瓶 (或用大试管、锥形瓶) /试管以及可抽动铜丝
注:可抽动铜丝的作用为随时控制反应的发生和停止。
(2)净化装置:盛有浓硫酸的试剂瓶吸收二氧化氮中的水蒸气
(3)收集装置:向上排空气法
(4)尾气处理方法
①碱液吸收法
2NO2+2NaOH===NaNO3+NaNO2+H2O
NO2+NO+2NaOH===2NaNO2+H2O
NO2、NO的混合气体能被足量烧碱溶液完全吸收的条件是n(NO2)≥N(NO)。一般适合工业尾气中NOx的处理。
②催化转化法
在催化剂、加热条件下,氨可将氮氧化物转化为无毒气体(N2)或NOx与CO在一定温度下催化转化为无毒气体(N2和CO2)。一般适用于汽车尾气的处理。
3、检验方法
(1)观察法:产生红棕色气体
(2)将气体通入AgNO3溶液颜色变浅,但无沉淀生成
(3)将其通入水中,若红棕色褪去,而在瓶口又重新出现红棕色气体,则该气体为二氧化氮。
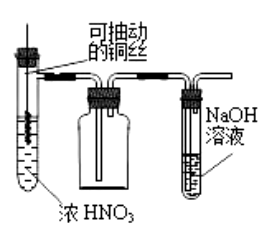
十、一氧化氮的实验室制备
1、反应原理:
Cu+8HNO3(稀)=3Cu(NO3)2+2NO↑+4H2O
2、实验装置:
(1)发生装置:分液漏斗、圆底烧瓶 (或用试管以及可抽动铜丝)
注:可抽动铜丝的作用为随时控制反应的发生和停止。
(2)净化装置:用水除去杂质除去二氧化氮,再用盛有浓硫酸的试剂瓶吸收一氧化氮中的水蒸气
(3)收集装置:由于NO的密度与空气相近,所以只能用排水法收集
(4)尾气处理方法:同二氧化氮
3、检验方法
打开封闭试管口 (或其他装有气体的容器)使容器内气体与空气接触。若容器内原本为无色无味的气体,打开容器口后在容器口产生棕色且蒂有刺激性气味的气体,则原气体为NO。
十一、氯化氢的实验室制备
1、反应原理:
高沸点酸可与低沸点酸的盐反应,生成低沸点酸。浓H2SO4是难挥发的高沸点酸,盐酸是挥发的低沸点酸,实验室就是用浓H2SO4与NaCl晶体共热来制取氯化氢气体:
①NaCl+H2SO4(浓) NaHSO4+2HCl↑
NaHSO4+2HCl↑
②NaCl+H2SO4(浓) Na2SO4+HCl↑
Na2SO4+HCl↑
2、实验装置
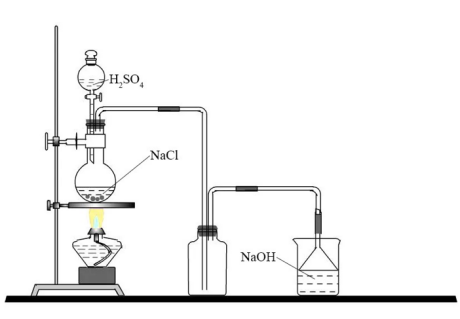
(1)发生装置:由分液漏斗、圆底烧瓶等组装的固液加热型制气装置。
(2)净化装置:用盛有浓硫酸,无水硫酸铜,无水氯化钙,五氧化二磷吸收水蒸气,干燥。
(3)收集装置:向上排空气法
(4)尾气处理装置:用 NaOH溶液等碱性液体吸收多余的HCl,防止HCl污染空气,且由于氯化氢易溶于水应用防倒吸装置
3、验满方法
(1)用玻璃棒蘸浓氨水,放在集气瓶口,如果有白烟生成,则说明HCl收集满
(2)将湿润紫色石蕊试纸至于集气瓶口,若紫色石蕊试纸变为红色,则证明已收集满
4、检验方法
通入蒸馏水中,制得HCl溶液,加入硝酸银溶液,若出现白色沉淀,再加入硝酸溶液震荡,若白色沉淀不溶解,则可说明原气体为氯化氢。

- 全部评论(0)
