范德华力、氢键对物质物理性质的影响有哪些规律?
时间:2021-08-23 20:29 来源:未知 作者:化学自习室 点击: 次 所属专题: 分子性质
版权申明:凡是署名为“化学自习室”,意味着未能联系到原作者,请原作者看到后与我联系(邮箱:79248376@qq.com)!
范德华力、氢键都是分子间作用力的组成部分。组成和结构相似 的分子,相对分子质量越大时范德华力越强;若相对分子质量近似相 等,则分子极性越强时范德华力越强。由于氢键中电正性的氢原子与 电负性较强的F、O、N等原子间有一定程度的轨道重叠作用,所以氢键一般比范德华力强的多,但轨道重叠程度又比共价键小的多,所以氢 键又比共价键弱的多。范德华力、氢键对物质物理性质的影响主要表 现在物质的熔点、沸点、溶解性上。
(1)分子晶体的熔点、沸点。
组成和结构相似的分子,一般随着相对分子质量的增大,范德华力增强,熔点、沸点升高。例如:F2、Cl2、Br2、I2的熔点依次为一219. 6°C、 -101°C,-7. 2°C ,113. 5°C。再如下面的两个图表中所示,大部分物质均符合该规律。
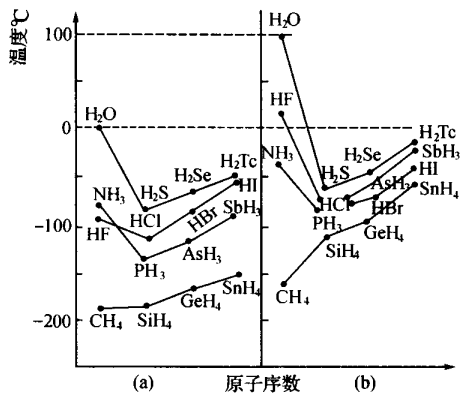
同族非金属元素形成的组成和结构相似的氢化物分子,一般随相对分子质量的增大,范德华力增强,熔点、沸点升高。但是,NH3、 H2O、HF分子间的氢键作用比同族的其他氢化物的范德华力强,所以 这三种物质的熔点、沸点反而是同族氢化物中最高的。具体如下所示,
(a)组为熔点,(b)组为沸点。
相对分子质量接近的物质,分子的极性越强,范德华力越强,熔点、沸点越高,如N2与CO两种物质中极性分子CO沸点(一191.5°C)比 非极性分子N2( —195. 8°C)沸点高;有氢键作用的物质熔点、沸点均比没有氢键作用的物质高;而形成氢键几率大的物质熔点、沸点又比氢键几率小的物质高。各物质的沸点如下表所示。 ,
表2 —些物质的沸点比较
| 物质类别 | 无氢键的物质 | 有氢键的物质 | 氢键几率大的物质 | |
非极性分子 | 极性分子 | |||
CH3CH3 | HCHO | CH3OH | ||
沸点/℃ | -88.6 | -19. 5 | 65 | |
CH3CH2CH3 | CH3CHO | CH3CH2OH | HCOOH | |
沸点/℃ | -42 | 20.8 | 78 | 101 |
CH3CH2CH2CH3 | CH3CH2CHO | CH3CH2CH2OH | CH3COOH | |
沸点/℃ | -0. 5 | 49 | 97.4 | 118 |
分子内可形成氢键的物质,其分子间形成氢键的机会减少,会导致 其熔点、沸点低于同类化合物。如邻位硝基苯酚的沸点为45°C,而间 位或对位硝基苯酚分别为96°C和114°C。
(2)分子晶体的溶解性。
分子晶体的溶解性遵循相似相溶原理,即极性分子易溶于极性溶 剂,非极性分子易溶于非极性溶剂。
极性分子在极性溶剂水中,如果溶质分子与水分子间形成氢键,促 使分子间的结合,则有利于溶质分子的溶解,如NH3在水中的溶解度 很大,0°C时1体积的水可以溶解1 200体积的氨,比HCl、HBr等物质 要大的多。这里除氨分子有很强的极性外,更重要的是氨分子和水可 以形成分子间的氢键。
在这些物质中,分子较小而且是液态的溶质往往可以与水互溶,如 下表中的乙醇、乙酸等。同为可与水形成氢键的物质,随着烃基的增 大,分子的极性减弱,溶解性依次减弱,如各有机物在常温时的溶解性 如下表所示。
表3各有机物常温下的溶解度
醇类 | g/100 g H2O | 醛类 | g/100 gH2O | 羧酸 | g/100 g H2O |
CH3OH | ∞ | HCHO | CO | HCOOH | ∞ |
CH3CH2OH | ∞ | CH3CHO | CO | CH3COOH | ∞ |
CH3CH2CH2OH | ∞ | CH3CH2CHO | 20 | CH3CH2COOH | ∞ |
CH3CH2CH2CH2OH | 8 . | CH3CH2CH2CHO | 4 | CH3CH2CH2COOH | ∞ |
CH3CH2CH2CH2CH2OH | 2.7 | CH3CH2CH2CH2CHO | 微溶 | CH3CH2CH2CH2COOH | 3.7 |
另外,如果溶质分子形成分子内氢键,则在极性溶剂中的溶解度减 小,而在非极性溶剂中的溶解度增大。例如在20°C时,邻位硝基苯酚 和对位硝基苯酚在水中的溶解度之比为0.39 = 1,而在苯中溶解度之 比为1.03 : 1。 ’
非极性分子虽然在水中溶解度不大,但若该分子的相对分子质量 越大,则与水分子之间的范德华力就越强,在水中溶解度就越大。例如 20°C时,稀有气体在水中的溶解度(mL/1 L H2O)为:
He:13. 8,Ne:14. 7,Ar:37. 9,Kr:73. 0,Xe:110. 9,Rn:230. 0。

- 全部评论(0)
