杂化轨道理论
时间:2012-05-30 18:56 来源:未知 作者:程波 点击: 次 所属专题: 杂化轨道理论
版权申明:凡是署名为“化学自习室”,意味着未能联系到原作者,请原作者看到后与我联系(邮箱:79248376@qq.com)!
杂化轨道理论
电子配对法阐明了共价键的本质、特征和类型,但在解释多原子分子的几何形状(或空间构型)方面遇到了困难。例如C原子只有两个成单电子,但能形成稳定的CH4分子,所以电子配对法不能说明甲烷分子为什么是正四面体构型的分子。1931年鲍林提出杂化轨道理论,满意地解释了许多多原子分子的空间构型。
杂化轨道理论认为:
①形成分子时,由于原子间的相互作用,使同一原子中能量相近的不同类型原子轨道,例如ns轨道与np轨道,发生混合,重新组合为一组新轨道.这些新轨道称为杂化轨道。杂化轨道的数目等于参与杂化的原子轨道数目。如一个2s轨道与三个2p轨道混合,可组合成四个sp3杂化轨道;一个2s轨道与二个2p轨道混合,可得三个sp2杂化轨道;一个2s轨道与一个2p轨道混合,可得二个sp杂化轨道。
②杂化轨道的电子云一头大,一头小,成键时利用大的一头,可以使电子云重叠程度更大,从而形成稳定的化学键。即杂化轨道增强了成键能力。
③杂化轨道可以分为等性杂化和不等性杂化。等性杂化是所组合的一组杂化轨道的成分都相同的杂化。如甲烷中的C原子所生成的四个sp3杂化轨道,每个杂化轨道各含1/4的s轨道成分,3/4的p轨道成分。不等性杂化是所组合的一组杂化轨道的成分不全相同的杂化,如氨分子中的N原子所生成的四个sp3杂化轨道中,一个杂化轨道含0.3274的s轨道成分,0.6726的p轨道成分;其余三个杂化轨道各含0.2242的s轨道成分,0.7758的p轨道成分。
杂化有多种方式,视参加杂化的原子以及形成的分子不同而不同。
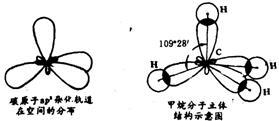
①sp3杂化——这是原子最外层的1个s轨道和3个p轨道发生的杂化。杂化以后形成四个等价的sp3杂化轨道。碳原子在与氢原子形成甲烷分子时就发生了sp3杂化。发生杂化时,碳原子的2s轨道和3个2p轨道发生混杂,形成4个能量相等的杂化轨道,碳原子最外层的4个电子分别占据1个杂化轨道。
每一个sp3杂化轨道的能量高于2s轨道能量而低于2p轨道能量;杂化轨道的形状也可以说介于s轨道和p轨道之间。
四个sp3杂化轨道在空间均匀对称地分布——以碳原子核为中心,伸向正四面体的四个顶点。这四个杂化轨道的未成对电子分别与氢原子的1s电子配对成键,这就形成了甲烷分子。
杂化轨道理论不仅说明了碳原子最外层虽然只有2个未成对电子却可以与4个氢原子形成共价键,而且很好地说明了甲烷分子的正四面体结构。
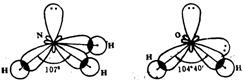
在形成H2O、NH3分子时,O、N原子实际上也发生了sp3杂化。与C原子杂化不同的是N、O原子最外层电子数分别为5个和6个,因而四个sp3杂化轨道里必然分别有1个和2个轨道排布了两个电子。这种已经自配对的电子被称为孤对电子。N和O的未成对电子分别与H原子的1s电子结合就形成了NH3分子和H2O分子。
孤对电子相对来说带有较多的负电荷。受孤对电子云的排斥,NH3分子中N-H键间的夹角被压缩为107o,H2O分子中O—H键间的夹角被压缩到104o401。
含有孤对电子的杂化被称为不等性杂化。NH3和H2O分子中N和O都发生了不等性sp3杂化。
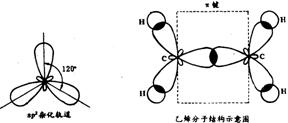
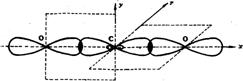
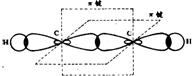
②sp2杂化——碳原子在形成乙烯(C2H4)分子时,每个碳原子的2S轨道与两个2p轨道发生杂化,称为sp2杂化。杂化后形成3个杂化轨道。它们的形状与sp3杂化轨道相似,在空间以碳原子梭为中心指向平面正三角形的三个顶点。未杂化的l个2p轨道则垂直于杂化轨道所在的平面。3个sp2杂化轨道与未杂化的 1个2p轨道各有1个未成对电子。两个碳原子分别以1个sp2杂化轨道互相重叠形成σ键,两个碳原子的另外4个sp2杂化轨道分别与氢原子结合。所有碳原子和氢原子处于同一平面上,而两个碳原子未杂化的2p轨道垂直于这个平面。它们互相平行,彼此肩并肩重叠形成π键。所以,在乙烯分子中两个碳原子是以双键相结合,双键由一个σ和一个π键构成。
此外,BF3分子中的B原子,SO3分子中的S原子都是发生sp2杂化的。这些分子都呈平面三角形。
③sp杂化——形成CO2分子时,碳原子1个2s轨道与1个2p轨道发生杂化,形成两个sp杂化轨道。两个sp杂化轨道在X轴方向上呈直线排列,未杂化的两个即轨道分别在Y轴方向和Z铀方向垂直于杂化轨道。两个氧原子各以一个2p轨道与碳原子的sp杂化轨道重叠形成σ键。而两个氧原子的另一个未配对的2p轨道分别在Y周 轴方向和Z轴方向与碳原子的未杂化的2p轨道“肩并肩”重叠形成π键。所以CO2分子中碳、氧之间以双键相结合。
碳原子在形成乙炔(C2H2)时也发生sp杂化,两个碳原子以sp杂化轨道与氢原子结合。两个碳原子的未杂化2p轨道分别在Y轴和Z轴方向重叠形成π键。所以乙炔分子中碳原子间以叁挺相结合。
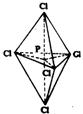
④sp3d杂化——磷原子在形成PCl5分子时,除最外层s、p轨道参与杂化外,其3d轨道也有1个参加了杂化,称为sp3d杂化。杂化后形成5个杂化轨道,其中各有1个未成对电子。5个杂化轨道指向三角双锥的5个顶点,并与氯原子配对成键。
除以上杂化方式外,还有其它的杂化,这里从略。可以看出,杂化方式与分子的空间结构形状有关。一般地说,发生sp3杂化时,形成的分子是正四面体,杂化原子处于中心;发生不等性sp3杂化时,如有一对孤对电子,则分子呈三角锥形,杂化原子处于锥顶。如果有2对孤对电子,则分子呈V型;发生sp2杂化时,分子呈平面三角型,杂化原子处于正三角形中心,未杂化的p电子通常形成π键(构成双键);发生sp杂化时,分子呈直线型,未杂化的p电子通常也参与形成π键(构成双键或叁键);发生sp3d杂化时,分子是三角双锥形。杂化原子处于双三角雄的中心。

- 全部评论(0)