如何比较强碱弱酸酸式盐溶液中的离子浓度大小?
时间:2021-09-14 07:42 来源:未知 作者:化学自习室 点击: 次 所属专题: 离子浓度大小比较
版权申明:凡是署名为“化学自习室”,意味着未能联系到原作者,请原作者看到后与我联系(邮箱:79248376@qq.com)!
在高中化学教学中,溶液中离子浓度大小的比较是一个重要知识点。对 于强碱弱酸酸式盐NaHA溶液中离子浓度大小的比较更是学生学习和教师教学的难点。而且离子浓度的大小顺序还存在不同的观点:
(1)金建忠:电离超过水解的强碱弱酸盐NaHA溶液,只要浓度不太稀,
其离子浓度顺序都是c(Na+ )>c(HA- )>c(H+ )>c( A2- )>c(OH-);
水解超过电离的强碱弱酸盐NaHa溶液,只要浓度不太稀,其离子浓度顺序都是
c(Na+)>c(HA)>c(A2-) >c(OH-)>c(H+)
(2)李鹏飞、唐悦:NaHA溶液中离子浓度大小与NaHA的物质的量浓度有关。
(3)中学化学教学中一般观点:
电离超过水解的强碱弱酸盐NaHA溶液, 只要浓度不太稀,其离子浓度顺序都是c(Na+)>c(HA-) >c(H+) >c(A2-) > c(OH-);
水解超过电离的强碱弱酸盐NaHA溶液,只要浓度不太稀,其离子 浓度顺序都是c(Na+)>c(HA-) >c(OH-) >c(H+) >c(A2-)。
1、NaHA溶液中离子浓度大小的定性分析
中学化学教学中对NaHA溶液中离子浓度大小的比较通常是这样分析的:
二元弱酸酸式盐NaHA溶液中存在下列平衡:
H2O H++OH- (1)
H++OH- (1)
HA-  H++ A2-(2)
H++ A2-(2)
HA-+ H2O OH-+ H2A (3)
OH-+ H2A (3)
根据NaHA溶液中存在的电离和水解平衡得到下列结论:
(1)由于HA-存在着水解和电离,且水解和电离都只是部分发生,因而
c(Na+ )>c(HA- )>c( A2- )
(2)溶液中c(H+)的关系:c水电离(H+)=c水电离(OH-),cHA电离(H+) =c(A2-),c(H+ )=c水电离(H+ )+cHA电离(H+ )=c水电离(H+ )+c( A2-),则c(H+)>c(A2-)。
(3)溶液中c(OH-)的关系:c水电离(OH-)=c水电离(H+),cHA电离(OH-) =c(A2-),c(OH- )=c水电离(OH- )+cHA电离(OH- )=c水电离(OH- )+c( A2-),则c(OH-)>c(A2-)。
(4)若水解程度大于电离程度,溶液呈碱性,c(OH-)>c(H+)
(5)若电离程度大于水解程度,溶液呈酸性,c(H-)>c(OH-)
因此,水解程度大于电离程度的NaHA溶液中,离子浓度关系为c(Na+ )>c(HA- )>c(OH- )>c(H+)>c(A2-);
电离程度大于水解程度的NaHA溶液 中,离子浓度关系为c(Na+ )>c(HA- )>c(H+ )>c(A2-)>c(OH-)。
必须指出的是,上述讨论中将c(A2-)的来源仅仅认为是HA-电离产生 的。但根据酸碱质子理论,溶液中A2-可有两种途径产生:
HA-+ H2O  H3O++ A2-
H3O++ A2-
HA-+ HA- H2A + A2-
H2A + A2-
HA-和H2O都能作为碱接受质子。因而上述结论是不准确的。
2.NaHA溶液中离子浓度大小的定量近似计算
我们可以通过定量计算讨论NaHA溶液中离子浓度大小关系,其理论分 析如下:
设20 ℃时,二元弱酸的酸式盐NaHA溶液的物质的量浓度为c mol • L-1, NaHA溶液中存在下列平衡:
H2O H++OH- Ka1= c(H+ ) ×c(OH-) (1)
H++OH- Ka1= c(H+ ) ×c(OH-) (1)
HA-  H++ A2-
H++ A2- ![]() (2)
(2)
HA-+ H2O OH-+ H2A
OH-+ H2A ![]() (3)
(3)
根据物料守恒和电荷守恒关系,溶液中微粒间物质的量浓度存在下列关系:
c(Na+) = c(H2A)+c(HA-)+c(A2-) (4)
c(Na+)+c(H+) = c(OH-) +c(HA-) + 2c(A2-) (5)
其质子守恒关系为
c(H2A)+c(H+)= c(OH-)+c(A2-) (6)
对(6)式处理得到
![]() (7)
(7)
![]() (8)
(8)
理论上说,根据(8)式就能够计算出溶液中各离子的浓度,但实际计算中通常 作下列近似:
(1)HA—进一步作酸式或碱式解离的趋势都比较小,因此c(HA-) ≈c,(8)式可以简化
![]()
(2)当cKa2> 20Kw,c> 20Ka1时,![]()
(3)当cKa2< 20Kw,c< 20Ka1时,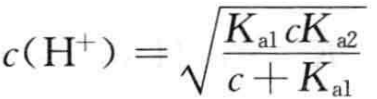
(4)当c>20Kw,![]()
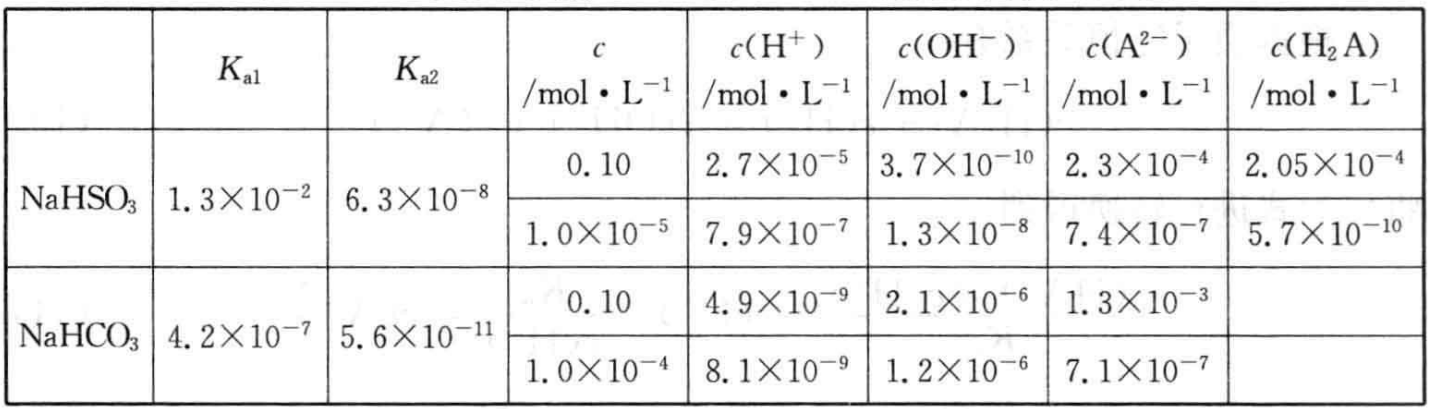
根据上述分析分别计算不同浓度的NaHSO3和NaHCO3溶液中离子的 浓度,得到表2-12所示结果。
表2-12不同浓度的NaHSO3和NaHCO3溶液中离子的浓度
3.NaHA溶液中离子浓度大小分析
分析NaHA溶液中离子浓度大小的基本方法是根据NaHA在水中存在的电离和水解平衡,通过物料守恒和电荷守恒建立离子浓度的定量关系,例如HC1 溶液中存c(H+) = c(Cl-) +c(OH-),NaOH 溶液中存在 c(H+) +c(Na+) = c(OH-)。因此,根据物料守恒和电荷守恒建立离子浓度的定量关系在实际计算时,是必须进行近似处理的,否则无法计算且计算也没有意义。
在中学化学课程中进行电解质溶液离子浓度大小比较的教学中,其目的并非要学生具体计算离子浓度,仅是为了建立质量守恒和电荷守恒,并应用质量守恒和电荷守恒原理解决电解质溶液中的电离和水解平衡问题。
中学化学教学中强碱弱酸酸式盐NaHA讲得最多的是NaHSO3和NaHCO3溶液。NaHCO3溶液中,我们根据HCO3-只能部分水解和部分电离的事实,很容易确定c(Na+)>c(HCO3-)>c(CO32-),又由于HCO3-的水解程 度大于电离程度,且电离和水解都只能部分发生,因而c(HCO3-)>c(OH-)> c(H+)
问题是如何确定c(CO32-)、c(H+), c(OH-)三者的浓度大小关系。 对于NaHA溶液中c(A2-)与c(OH-)的比较可以进行下列分析:
![]() (9)
(9)
根据(9)式有
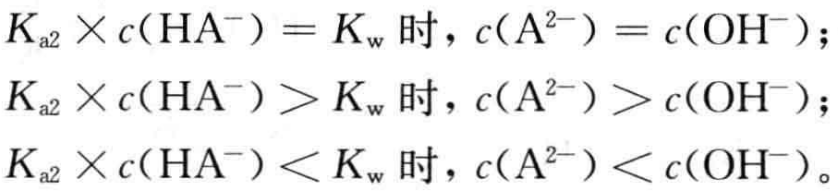
通常情况下NaHA溶液中基本满足
![]() ,
,
因此,在浓度不是很低的NaHA溶液中,存在c( A2- )>c(OH-)的关系。
对于NaHA溶液中c(A2-)与c(H+)的比较可以进行下列分析:
根据质子守恒关系有
c(H2A)+c(H+)= c(OH-)+c(A2-) (10)
将(10)式进行转换得到
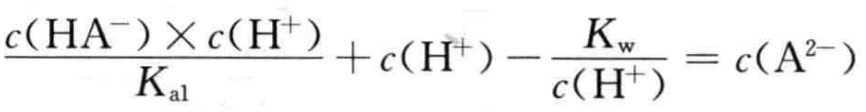 (11)
(11)
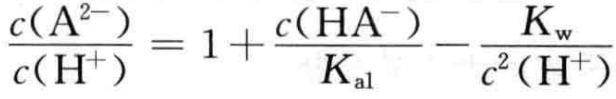 (12)
(12)
根据(12)式可得:
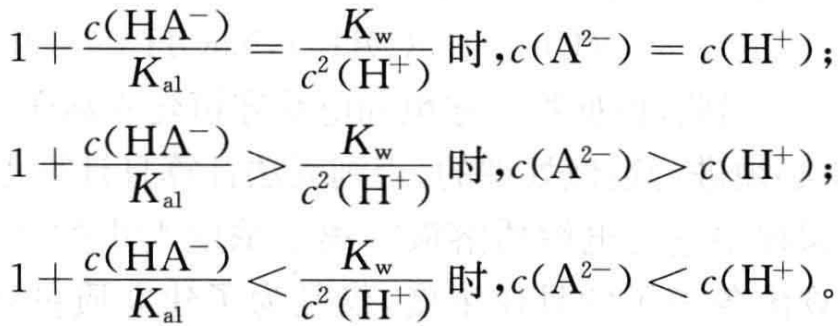
通常情况下NaHA溶液中基本满足
![]()
因而,在浓度不是很低的NaHA溶液中,存在c(A2-) >c(H+)的关系。
根据以上分析我们得到,通常情况下,浓度不是很低的NaHSO3和 NaHCO3溶液中离子浓度的关系分别为
NaHCO3溶液:c(Na+)>c(HCO3-)>c(CO32-) >c(OH-)>c(H+)
NaHSO3溶液:c(Na+)>c(HSO3-)>c(SO32-) >c(H+)>c(OH-)
参考文献
[1]金建忠.弱酸酸式盐溶液中的若干问题[J].中学化学教学参考.2010(1〜2)
[2]李鹏飞.NaHSO3溶液中H+浓度真的大于SO32-浓度吗[J].化学教学,2011(8)
[3]唐悦.NaHCO3溶液中CO32-浓度一定小于OH-浓度吗[J].中学化学教学参考.2010(7)
[4]华中师范大学等.分析化学(上)[M].第3版.北京:高等教育出版社,2001:104〜105

- 全部评论(0)
