关于碳族元素的一些问题
时间:2021-11-02 15:06 来源:未知 作者:王笃年 点击: 次 所属专题: 碳族
版权申明:凡是署名为“化学自习室”,意味着未能联系到原作者,请原作者看到后与我联系(邮箱:79248376@qq.com)!
1、地壳中硅元素质量分数很大(26%),且单质硅的性质很稳定,可为什么地壳中却不存在单质硅?
对于这个问题我们只能做这样的猜测:地球氛围是氧化性的,大气中存在大量的O2单质,而硅元素是 一种亲氧元素(矿物学中,根据常见矿物的组成把元素分为“亲硫元素”和“亲氧元素”),在漫长的地球发育过程中,地壳里的硅元素全部被氧结合掉,形成了以硅氧四面体为结构基础的石英或各种硅酸盐矿物。
科学研究发现,人工制得的单晶硅表面总是被一 层薄二氧化硅覆盖着,这也充分说明硅很容易与空气中的氧气化合。但这一层二氧化硅非常致密,一旦在硅表面上形成,就隔绝了硅与空气进一步接触,因而单质硅在空气中能稳定存在。
2、同为第IVA族元素,为什么碳、硅、错、锡的 +4价化合物稳定而铅却是+2价化合物稳定?
首先我们注意到,碳族元素都有+ 2价和+4价2 种正化合价(氧化数),这与它们原子价电子结构 ns2np2有关,s亚层与p亚层电子本身的能量不同,在不同反应条件下,原子可以只失去(偏离)np2的2个 电子显+ 2价,也可能把最外层的4个价电子全部失 去(偏离)显+ 4价。
对于碳、硅、错、锡来说,由于其最外层的ns2np2亚层电子能量差较小,在反应中容易全部失去(偏离),所以在氧化剂充足的情况下,一般是显+ 4价。虽在氧化剂不足时也可以形成+ 2价态化合物(如 CO、SnCl2等),但是+ 2价态化合物往往具有较强的还原性。
铅处于第六周期,其原子核外已出现 4f 亚层,按核外电子排布的能级交错规律与能量最低原理,核外电子进入原子轨道时,要先填 6s 再填 4f,之后才填充 6p 亚层,致使 6s、6p 亚层电子之间能力差较大且 6s 的一对电子能量突出地低,不易失去(称为“惰性电子对”),故铅主要稳定氧化数是+ 2而非+ 4,+4价铅的化合物具有强氧化性,如PbO2。
这种低价态较稳定而高价态具有强氧化性的情况,同样表现在与铅同周期的Tl + 1价稳定而+ 3价 化合物具有强氧化性)、Bi( + 3价化合物稳定而+ 5 价化合物具有强氧化性)等元素身上。
3、锡和铅的金属性到底哪个强?
学习元素周期律时,有些同学提出了如下问题: 根据元素周期律,同主族元素从上到下,金属性增强, 铅的金属性应该比锡强。但在金属活动顺序表中,锡却排在铅的前边,说明锡比铅活泼。对此应该如何理解呢?
关于这个问题,有人试图用“金属性”与“金属活 动性”这2个概念的不同来解释这个问题,认为“金属 性是铅比锡强,而金属活动性则是锡比铅强",事实果然如此吗?
元素的金属性是指元素的气态原子失去电子的 性质,可以用电离能(从气态原子上去掉电子时,需要 提供的能量,用符号“I”表示)来量度,电离能越小,则元素的金属性越强.査阅有关的化学数据可知,锡的 第一电离能( I1,即从气态锡原子上去掉1 mol 电子 时,需要吸收的能量,下同)为709 kJ•mol-1,而铅的第一电离能为716 kJ•mol-1,故锡应该比铅容易失去电子,其金属性比铅强。
当然,锡和铅在化学反应中往往同时失去2个电 子,我们不妨把它们的合在一起比较:
锡:I1+I2 = 709 kJ• mol-1+ 1412 kJ • mol-1= 2 121 kJ•mol-1
铅:I1 + I2 =716 kJ• mol-1+1 450 kJ • mol-1= 2 166 kJ• mol-1
显然,同时去掉2个电子,也是锡比铅容易。
金属活动性则是指金属在水溶液中失去电子的倾向,金属活动性除了与元素原子的电离能有关外, 还与金属原子的升华能、离子的水合能的大小等因素有关。金属活动性通常用金属的标准电极电位(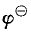 )来量度值越低,则金属单质的还原性就越强,金属活动顺序表就是以此为依据编写的。
)来量度值越低,则金属单质的还原性就越强,金属活动顺序表就是以此为依据编写的。
查得锡和铅在相同情况下的辟值(“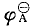 ”中的 “A”,表示该电极电位是酸性条件下的值)如下:
”中的 “A”,表示该电极电位是酸性条件下的值)如下:
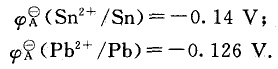
显然,在水溶液中也是锡的还原性强。
所以,无论金属性还是金属活动性,都是锡比铅强。那种“金属性是铅强,而金属活动性则是锡强”的说法,是为了刻意解释教科书而臆造出来的,没有科学依据。
为什么会出现“锡在铅的上方,其金属性却比铅强''这种“违反”同一主族元素性质递变规律(从上到 下金属性增强)的情况呢?
其实,这是元素周期表中“锕系收缩”造成的效应之一,因为铅位于周期表中第六周期,第六周期比第五周期多出了锕系中锕元素后面的14种元素,虽然锕系的15种元素间原子半径比较接近,性质也很相似, 但15种元素的原子半径连续减小的结果,使锕系后 边元素的原子半径比锕系前边的元素显著地减小。这种效应,叫做“锕系收缩”,对锕系后的元素性质产生了很大的影响。
元素表现出的金属性、非金属性都是核电荷数和原子半径这2种因素共同作用的结果。而这2种因素是一对矛盾体:对于从上到下的同一主族元素,一方 面,核电荷数增大,使核对最外层电子的吸引力增强 (对应的,应该是金属性减弱、非金属性增强);而另一 方面,原子半径增大,使原子核距最外层电子越来越 远,对最外层电子的吸引力减弱(对应的,应该是金属性增强、非金属性减弱)。
对于大多数的主族元素来说,是原子半径的增大这一因素起主导作用,故有“同一主族元素,从上到下金属性增强,非金属性减弱"的结论。但是因为铅受“锕系收缩”的影响,原子半径相对较小,故从锡到铅,原 子半径的增大所起的作用(使原子失电子能力增强) 减弱,而核电荷数增大(增大了 32)所起的作用(使原子核对最外层电子的控制力增强,原子失电子能力减弱)增强。于是导致了锡在铅的上方,反而金属性比铅强的情况出现,锡的金属活动性比铅强,也主要是由于其金属性强所导致的,而非其他因素。
所以,中学化学里很多规律性的东西往往有其使用范围,不可在任何情况下死搬硬套。

- 全部评论(0)
