关于硝酸性质的问题
时间:2021-11-03 08:45 来源:未知 作者:王笃年 点击: 次 所属专题: 硝酸
版权申明:凡是署名为“化学自习室”,意味着未能联系到原作者,请原作者看到后与我联系(邮箱:79248376@qq.com)!
1、浓硝酸和稀硝酸的氧化性哪一个更强?
有同学提出,铜与浓硝酸反应产物为NO2而与 稀硝酸反应产物为NO,浓硝酸中的氮元素在反应中只降低了 1价(1个氮原子只得1个电子),而稀硝酸中的氮元素则降低3价(1个氮原子得3个电子),这岂不说明稀硝酸得电子能力更强、氧化性更强吗?
1个原子得几个电子并不能用来说明其氧化性的强弱,正如1个铝原子在反应中可以失去3个电子,而 1个钠原子只能失去1个电子,并不能据此说明铝的还原性比钠强是一样的道理。
根据浓、稀硝酸与铜反应时的难易(剧烈程度)可以比较浓、稀硝酸氧化性强弱:铜片放入浓硝酸,立即发生剧烈作用,溶液变为绿色的同时,有大量红棕色的NO2逸出,而铜片放入稀硝酸,开始阶段反应则很缓慢。从理论上讲,比较不同物质的氧化性强弱应该根据电极电势高低判断,不管浓硝酸还是稀硝酸,都是硝酸根离子得电子,浓硝酸的电极反应式为NO3- + 2H+ + e- =NO2+H2O,稀硝酸的电极反应式为 NO3- +4H++3e- =NO + 2H2O,由能斯特方程式 知,它们的电极电势均与NO3-、H+的浓度有直接关系,二者浓度越大,电极电势值越高、氧化性越强。
2、为什么浓硝酸与铜反应时所得溶液呈绿色而不是蓝色?
单从反应的化学方程式看:Cu + 4HNO3(浓)= Cu(NO3)2+2NO2↑ +2H2O,似乎最终所得溶液应该呈现Cu(NO3)2的蓝色,但实际观察到的却是绿 色。我们不妨借助对CuCl2溶液呈绿色(含有蓝色的[Cu(H2O)4]2+和黄色的[CuCl4]-,蓝色与黄色的复合色为绿色)的分析思路对此做一分析:浓硝酸与铜反应所得溶液中,除了蓝色的[Cu(H2O)4]2+外,溶液中是否含有黄色的成分呢?其实溶液中溶解有该反应的另一产物NO2,而NO2溶解在浓硝酸中显黄色。放置日久的浓硝酸变黄色就是因为分解产生的NO2 溶解在浓硝酸中导致的,通过鼓入空气把NO2带出、 加水稀释使NO2歧化(3NO2+H2O = 2HNO3+NO)等手段,可以验证该假设的正确性——将其中的 NO2去除后,溶液会恢复单纯Cu(NO3)2溶液的蓝色。
这里就引出了另外一个问题:一般实验室常用浓硝酸的质量分数为69%,也含有一定比例的水,为什 么NO2不会被水反应掉呢?不是有3NO2+H2O = 2HNO3+NO吗?原来,浓硝酸的氧化性很强,足以 将NO氧化,也就是说,上述反应具有可逆性,化学方程式应该写作3NO2+H2O 2HNO3+NO,当把 NO2气体通入水中,由于初期溶液里HNO3浓度极低,平衡主要向右移动;随着反应的进行,HNO3浓度的增大,该反应将达到平衡状态,NO2主要发生溶解过程而非歧化反应。如果把NO通入浓HNO3中, 也可看到该反应从逆向达到其平衡状态的过程—— 随着NO的通入,浓硝酸逐渐变为黄色。
2HNO3+NO,当把 NO2气体通入水中,由于初期溶液里HNO3浓度极低,平衡主要向右移动;随着反应的进行,HNO3浓度的增大,该反应将达到平衡状态,NO2主要发生溶解过程而非歧化反应。如果把NO通入浓HNO3中, 也可看到该反应从逆向达到其平衡状态的过程—— 随着NO的通入,浓硝酸逐渐变为黄色。
3、为什么HNO3与盐酸混合(形成王水)后氧 化性会大为增强?
王水是浓硝酸与浓盐酸按照体积比1:3配合而成的,它可以溶解不溶于浓硝酸的金、铂等“惰性金属。
Au + HNO3 + 4HCl = H[AuCl4](四氯合金酸)+NO↑ +2H2O,
3Pt + 4HNO3+18HCl = 3H2[PtCl6](六氯合铝 酸)+4NO↑ +8H2O.
我们注意到,金和铂在反应后都不是形成了简单的金属离子,而是与氯离子结合,形成了配合物离子, 使溶液里游离的金属离子浓度大为降低,导致金属的电极电势值下降、金属的还原性增强,原本不能被硝 酸单独氧化的金、铝在这种情况下可以被硝酸氧化。
其实,很多金属与H+浓度相同的硫酸、盐酸反应的情况都有极大差异,如铁、铝等,它们在盐酸中迅速反应释放氢气,而在一般浓度的稀硫酸中反应则十分缓慢,这也与Cl-的配位作用密切相关.
4、王水由浓硝酸和浓盐酸配制而成,为什么 王水被金、铂还原为NO不是NO2?
首先我们要明确,为什么浓硝酸一般被还原为 NO2而稀硝酸却被还原为NO?可以这样考虑,NO3-是分步被还原的,其中的N元素先降低1价,即得还原产物NO2,如果是在浓硝酸里,HNO3的比例大而 H+的比例小,还原过程就到此为止了;而在稀硝酸里,由于含有大量的H2O,NO2会在H2O分子的作用下发生歧化,最终转化为NO。
我们也可以沿用上述问题2的解答思路,在浓硝酸里,即使反应体系局部区域有NO产生,也会立即被浓硝酸氧化:2HNO3(浓)+ NO = 3NO2+H2O.
王水的确是用浓硝酸和浓盐酸混合配成的,但我们应该注意到,王水中硝酸与盐酸的体积之比为1 :3, 也就是说,王水中HNO3的浓度大约被稀释到了浓硝酸的1/4,按照一般质量分数为69%的硝酸物质的量浓度约为16 mol・L-1计算,王水中HNO3浓度只有4 mol・L-1左右,虽然在HCl的“帮助”下其氧化性增强 了,但是还原产物却因为溶液中大量H2O的存在变 为NO,而非NO2。
5、实验室制备少量硝酸时,为什么选用曲颈瓶这种看上去有点奇怪的仪器?
工业上通过氨催化氧化法制取大量硝酸.实验室 里可以根据硝酸的挥发性,利用NaNO3,KNO3等硝酸盐与浓硫酸作用制取少量HNO3:
NaNO3+H2SO4(浓) NaHSO4+HNO3↑.
NaHSO4+HNO3↑.
有的教科书上有图1所示的装置图,从制硝酸的反应物性质与反应条件看,选用类似实验室制取Cl2 的“固-液加热”装置组合就可以了,为什么要选用曲颈瓶呢?
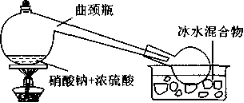
图1
这是由硝酸的特性决定的,HNO3具有强氧化性,特别是热的硝酸蒸气,对于橡皮塞、橡胶导管等具有强烈的腐蚀作用,选用曲颈瓶这种纯玻璃制品,可以避开橡皮塞、橡胶导管等的使用。

- 全部评论(0)
