关于氮的固定及氮氧化物的问题
时间:2021-11-03 09:10 来源:未知 作者:王笃年 点击: 次 所属专题: 氮的固定 氮氧化物
版权申明:凡是署名为“化学自习室”,意味着未能联系到原作者,请原作者看到后与我联系(邮箱:79248376@qq.com)!
1、氮的固定有哪些类型?各占多大比例?
氮的固定是一个特定的概念,是指把大气中单质 状态的氮元素转化为可被农作物吸收的氮的化合物(铵态氮NH4+或硝态氮NO3-的过程)可分为自然固氮和人工固氮两大类。其中自然固氮包括雷雨固氮、 植物(主要指大豆、苜蓿等豆科植物)根瘤菌固氮以及海洋藻类固氮等;而人工固氮则主要是指合成氨,由于氮的固定关乎农作物的产量,而人工固氮反应条件苛刻,科学家提出了“仿生固氮”的新思路,也叫“人工模拟生物固氮”,即利用某些高效催化剂的作用,实现常温、常压下固氮。
关于氮的固定可用图1表示.
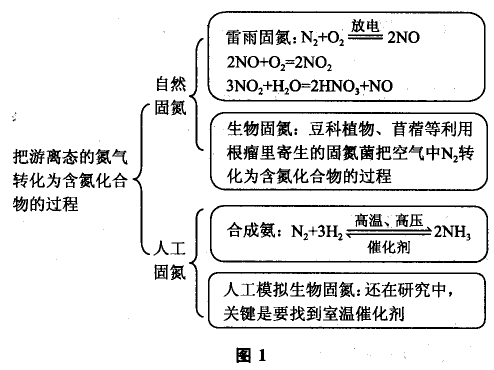
尽管现代合成氨工业不断发展,但据科学家估算,人工固氮在自然界全部固氮总量中只占很小的比例,不到1/4。
2、 “雷雨发庄稼”的过程中,最终产生了酸雨,对农作物损害是更大了吗?
土壤的成分非常复杂,里面含有碳酸盐、硅酸盐、 铝酸盐等多种具有中和酸的能力的物质,对酸具有一 定的“抵抗”作用,可及时将硝酸转化为硝酸盐。当然, 最主要的是,雷雨过程一般较短,一次雷雨不会产生浓度非常大的酸。
3、自然界和人类都在不停地进行固氮操作,那么 地球大气中的N2岂不越来越少了?
自然界中的很多元素都在不断地循环,氮也是一样,不管自然固氮还是人工固氮,固氮操作所得的化合物,最终主要变为有机物,而有机物在自然界的“寿命”都不是很长,动植物体内的氮元素主要以蛋白质形式存在,蛋白质最终的代谢产物为尿素,尿素水解变为NH3,而NH3在大气循环过程中则很快被氧化 为N2,另外,动植物死亡后的遗体也会在细菌作用下腐败,其中的含氮化合物最终也是变为氮元素的稳定形态N2,因此,对于大气这个巨大的“N2仓库”来说,N2 的量不会因为固氮作用而减少。
4、大气中含有丰富的N2、O2,为什么不考虑直接用N2、O2合成NO,进而制取硝酸或进行人工固氮?
首先从反应的自发性看,N2+O2=2NO的ΔG= + 87. 6 kJ·mol-1;ΔH== +91. 3 kJ·mol-1. ΔG 为正 值,说明该反应属于非自发反应,进一步计算该反应的平衡常数可知,25°C下平衡常数K在10-3量级,虽然对于吸热反应来说温度升高K值会增大,但即使温度升高到2 000 其K值仍非常小,仅在0.1左右, 这就意味着即便提供条件使该反应达到平衡状态,从平衡混合物中分离出NO也是一个不小的难题。其次,从反应动力学的角度看,该反应需要拆开键能都 很大的N2>O2分子,这需要极高的活化能,一般的加热手段很难达到要求,只有电火花才能引发该反应。所以,很难利用该反应进行氮的固定或者制取硝酸。
5、氮的哪些氧化物属于酸酐?
氮的主要氧化物有6种:N2O、NO、N2O3、NO2、 N2O4、N2O5,其中N2O3是亚硝酸(HNO2)的酸酐, N2O5则是硝酸(HNO3)的酸酐。
一般认为酸酐与含氧酸中氮元素的化合价必须 一致,NO2虽然与水作用可以形成HNO3:3NO2+H2O=2HNO3+NO,而且生产中也是通过该反应获得硝酸的,但NO2并不是HNO3的酸酐。不过,依据 2NO2+H2O = HNO2+HNO3的反应,也有NO2 是 HNO3、HNO2的“混酐”的说法。
6、如何鉴别NO2与溴蒸汽?
中学阶段的物质鉴别题都是为了考查考生对物质基本性质的掌握情况,并不一定有此真实的课题。NO2、Br2(g)都是红棕色、有强烈刺激性气味的气体, 外观上很难区分,它们都具有氧化性,比如都可以使湿润的KI-淀粉试纸变蓝,但是它们具有很多不同的物理、化学性质,可为鉴别提供依据。
方法1:向2种气体中加少量水、振荡,观察形成 溶液的颜色.一般情况下溶液呈无色的为NO2,而明显呈橙色的为溴蒸汽。
方法2:向2种气体中加AgNO3溶液,振荡,有 淡黄色沉淀AgBr产生的为漠蒸汽,无明显变化的为NO2,
方法3:加热或适度冷却法。
常温下红棕色的气体“NO2”并非单一成分,而是 2NO2 N2O4平衡混合物,而且其中无色成分N2O4 的比例很大,该体系受热时会因平衡移动使NO2比例显著增大,颜色变深;而恒容容器内Br2的浓度不会因受热而增大,颜色不变。理论上讲,对2种气体冷却时,NO2体系的颜色也应该明显变浅,而Br2蒸汽颜色变化不大(当然,冷却过度也会导致溴蒸汽凝结, 气体颜色变浅,但可以看到深红棕色液体出现,因此也可以借此把二者区分开来)。
N2O4平衡混合物,而且其中无色成分N2O4 的比例很大,该体系受热时会因平衡移动使NO2比例显著增大,颜色变深;而恒容容器内Br2的浓度不会因受热而增大,颜色不变。理论上讲,对2种气体冷却时,NO2体系的颜色也应该明显变浅,而Br2蒸汽颜色变化不大(当然,冷却过度也会导致溴蒸汽凝结, 气体颜色变浅,但可以看到深红棕色液体出现,因此也可以借此把二者区分开来)。
方法4:加压或减压法
将2种气体分别充入带活塞的密闭容器进行加 压或减压处理,根据平衡移动原理,2NO2 N2O4体 系在压强变化时,会发生明显的“先变深、再变浅”(加压时)或“先变浅、再变深”(减压时)的颜色变化过程, 而Br2蒸汽的颜色变化则是单调地变深(加压时)或 变浅(减压时)。
N2O4体 系在压强变化时,会发生明显的“先变深、再变浅”(加压时)或“先变浅、再变深”(减压时)的颜色变化过程, 而Br2蒸汽的颜色变化则是单调地变深(加压时)或 变浅(减压时)。
7、既然NO遇O2就会被氧化为NO2,那么 NH3催化氧化反应方程式里产物为什么不是NO2而 是NO?
氨的催化氧化反应是在450 °。左右的高温下发 生的,该温度下,NO2根本就不能存在,它在140 ℃以 上就已经完全分解为NO和O2了。所以反应的化学 方程式只能写作:4NH3+5O2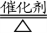 4NO+6H2O,而不能把产物写成NO2。
4NO+6H2O,而不能把产物写成NO2。
顺便提及,NO2虽说是一种客观存在的化学物质,但事实上我们并不能制得纯净的NO2,因为常温 下,NO2与N2O4平衡共存,0 °C以下则完全转化为无色液体N2O4;温度稍高它又会分解为NO和O2。

- 全部评论(0)
