化学平衡特征3问
时间:2021-11-04 15:12 来源:未知 作者:王笃年 点击: 次 所属专题: 平衡状态
版权申明:凡是署名为“化学自习室”,意味着未能联系到原作者,请原作者看到后与我联系(邮箱:79248376@qq.com)!
问题1、判断一个可逆反应达到平衡状态的方法有很多,比如反应混合物的密度不变、压强不变、反应体系的颜色不变等,哪一种是切实可靠的呢?
在学习化学平衡状态判断时,总有人想“省事”,试图通过总结归纳、简单记忆的办法解决问题。比如,
对于反应m A+n B ⇌ p C+q D,下列特征能不能说明其已经达到平衡状态了呢?
①A、B、C、D在体系内共存;
②体系的压强不再发生变化;
③混合气体的密度不再发生变化;
④反应的速率v(A)∶v(B)∶v(C)∶v(D)=m∶n∶p∶q;
⑤产物C的质量分数不再变化;
⑥产物D的物质的量分数不再变化;
⑦物质的量浓度c(A)∶c(B)∶c(C)∶c(D)=m∶n∶p∶q;
⑧用A表示的正反应速率与用B表示的逆反应速率数值相等;
这些“依据”,对于不同反应条件、不同特征的反应,有的有用,有的则不能用。
判断一个反应是否达到平衡状态,根本依据是化学平衡的本质特征—正反应速率与逆反应速率相等。至于该特征的具体表现是怎样的,要结合反应的具体特点(单纯气相还是气液、气固平衡,如果是单纯气相反应,反应前后气体体积是否相等),反应容器的特征(恒容容器还是恒压容器)进行分析。
靠死记硬背别人总结的“规律”“套公式”的方法,不可能很好地解决问题,请看下面的例题。
例(2012年江苏卷)将一定量纯净的氨基甲酸铵置于特制的密闭真空容器中(假设容器体积不变,固体体积忽略不计),在恒定温度下使其达到分解平衡:
H2NCOONH4(s)⇌2NH3(g)+CO2(g)。
可以判断该分解反应已经达到化学平衡的是 (填序号)。
A.2 v(NH3)=v(CO2);
B.密闭容器中总压强不变;
C.密闭容器中混合气体的密度不变;
D.密闭容器中氨气的体积分数不变。
命题人所选的反应非常特别—在恒温、恒容容器中,一种固体物质分解,产生两种气体。
显然,当容器中总压强不变时,意味着气体的物质的量不再变化,那么反应物固体的量也不会再发生变化,说明已经达到平衡(选项B);而气体的密度不再变化时,由于容器体积恒定不变,说明气体产物的量不再变化,那么反应物固体的量也不会再发生变化,达到平衡(选项C).而适用于很多场合的“某一成分(NH3)体积分数不变(选项D)”则不适用于此题—因为该体系内,只有产物中含有NH3、CO2两种气体,二者的体积比始终为2∶1,不论反应是否达到平衡状态,这个体积比始终不会变化。
可逆反应是否达到了平衡状态,宏观上还可以用Q、K关系进行判断,进而可以判断某时刻反应的宏观方向。
问题2、如图1,t1时刻达到平衡后,为什么 v正 不再继续减小,v逆 不再继续增大),而是一直维持 v正=v逆 的平衡状态呢?

回答此问题的关键,是理解清楚图中O点的化学含义。
在其他条件一定的情况下,影响正反应速率和逆反应速率的唯一因素是反应物、产物的浓度。达到平衡之前,由于正反应速率总是比逆反应速率大,单位时间内反应物减少的量(正反应)总比产生的量(逆反应)多,所以宏观上反应物的浓度是在减小的,而产物的浓度则不断增大。而一旦到达O点,v正=v逆,则意味着从此点开始,单位时间内反应物减少的量(正反应)与产生的量(逆反应)相等,宏观上反应物的浓度不再发生变化,产物的浓度也不再发生变化.那么,由反应物浓度决定的正反应速率不再变化,由产物浓度决定的逆反应速率也不再发生变化。只要外界条件不变,v正=v逆 的关系则不会发生改变,也就不存在v正继续减小、v逆继续增大的可能性了。
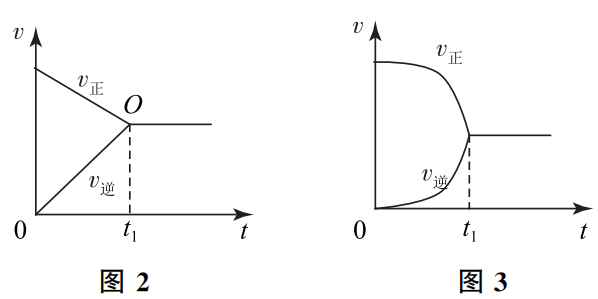
问题3、可逆反应从开始到平衡过程的速率图象,为什么一定是图1的样子,而非图2、图3的样子呢?
我们要明确,图1~3这些“速率-时间”图像的前提条件是:除反应物浓度一个变量外,其他反应条件(温度、反应器容积等)都是一定的。
对于一个从正反应开始的可逆反应而言,开始瞬间的 v正 必然处于最大值,因为这时反应物浓度是最大的,而v逆 则为0,因为逆反应的反应物(也就是产物)浓度为0。反应一旦开始,反应物变为产物,则反应物浓度下降,v正 随之减小;产物(逆反应的反应物)浓度不断上升,v逆 随之增大,直到二者达到相等的程度,形成化学平衡状态(图1的O点)。
这个 v正 减小、v逆 增大的过程不会是匀速的(图2所示),为什么呢?因为在达到平衡状态之前,反应是净向正反应方向进行的,净反应速率 v=v正-v逆,是随着时间的延长逐渐减小的,也就是说,开始阶段反应物浓度减小得快,而接近平衡时间段反应物浓度减小得慢。v正 是受反应物浓度影响的,故而 v正 减小的幅度也是先快而后慢。v逆 的变化情况论述同理。
基于以上论述可知,图3的情况( v正 减小的幅度及 v逆 增大的幅度先慢后快)就更不可能出现了。

- 全部评论(0)
