有关氢键问题集
时间:2024-02-03 17:01 来源:未知 作者:王笃年 点击: 次 所属专题: 氢键
版权申明:凡是署名为“化学自习室”,意味着未能联系到原作者,请原作者看到后与我联系(邮箱:79248376@qq.com)!
1.氢键是一种怎样的作用力?为什么要特别提出氢键这个概念?
“氢键”不是化学键,它只是一类较强的分子间作用力。
氢键概念的提出,是科学家在研究物质结构与性质关系的过程中,发现新问题、解决新问题的创造性思维的体现。
让我们以IVA-VIA族元素氢化物沸点(下表所示)递变规律为例,初步说明科学家提出氢键学说的思维过程。
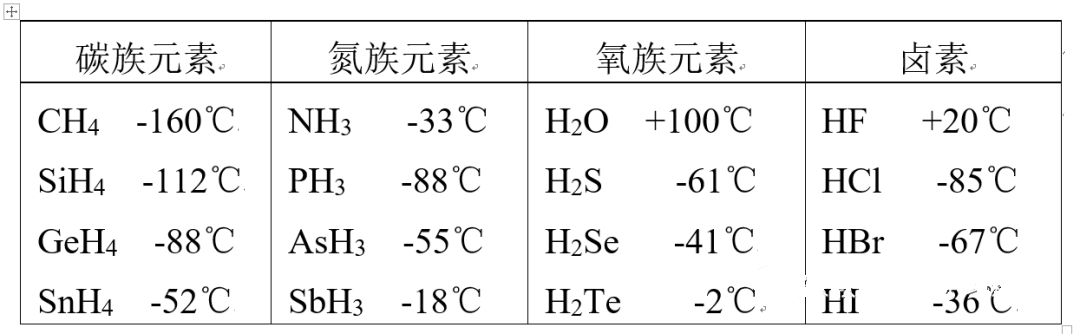
把上述有关数据描点连线,得到直观的图像:
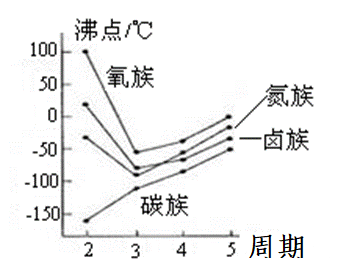
可以看到:碳族元素氢化物的沸点随相对分子质量的增大逐渐升高。
这容易理解,因为碳族元素氢化物分子均为非极性分子(极性相同),且分子均为正四面体型结构(分子形状也相同),其分子间力的强弱只跟相对分子质量有关。
而氮族、氧族、卤族元素氢化物除第二周期外,其它各周期元素氢化物的沸点也随相对分子质量增大而升高。
唯独第二周期元素氢化物沸点“反常(突出的高)”。
这似乎可用分子的极性强(相对于相对分子质量的影响,分子极性所起作用占主导地位)来解释。
但科学家综合考虑其它一些类似含氢化合物的各方面性质,提出了氢键学说:
当H原子与电负性很大、半径很小的X(F、O、N)原子结合时,电子云被对方强烈吸引,变为一个“几乎裸露的质子”,于是它能与另一个电负性很大(吸引了其它原子的电子云)且外层有孤对电子的Y(F、O、N等)原子产生较强的相互作用,形成:
x-H……Y
这种结构称为“氢键”。
氢键的强度远不如共价键,但是比一般分子间作用力强得多。
这样,运用氢键学说,就很好地解释了处于第二周期的N、O、F的氢化物沸点远高于同主族其他因素氢化物的事实。
这里让我们再次强调一下,氢键概念中虽然有个“键”字,但由于其强度远远达不到化学键的范畴,属于分子间作用力的一类。
2.氢键的形成,对物质的性质产生怎样的影响?
第一,影响物质的熔点、沸点。
自身分子间可形成氢键的物质,其熔、沸点往往比跟它相对分子质量差不多的物质高出许多。
除上述氢化物实例外,还可列举很多例子:
醇类(R-OH)、羧酸类化合物(R-COOH)跟相对分子质量与之相当的烃类( CxHy)比,熔点、沸点高出很多,原因就是其分子中既有原子半径小、电负性大的氧原子,又有跟氧原子直接相连的氢原子,容易形成分子间氢键。
硫酸是一种难挥发性的酸,说明其沸点极高。从其分子结构:
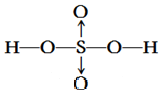
可知,硫酸分子中含有4个O和2个跟O相连的H,符合氢键的形成条件,分子间可形成大量氢键。
第二,氢键的形成对物质的溶解性有影响。
能够彼此间形成氢键的物质之间,容易相互溶解。如果某物质的分子可以跟H2O形成氢键,则该物质易溶于水。
如NH3具有非常大的溶解度,就可以用氢键理论加以解释;再如,乙醇(C2H5-OH)、乙酸(CH3COOH)、硫酸(HO-SO2-OH)等结构中含有羟基(-OH)的小分子化合物,都能够以任意比例溶解于水,因为它们的分子跟H2O间极易形成氢键。
有机小分子乙醛(CH3CHO)的性质,也许可以概括运用上述两方面的论述。乙醛的结构为:
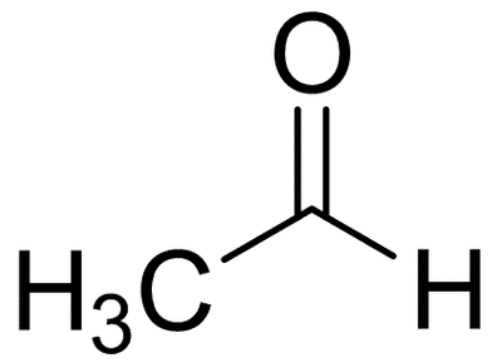
它有一个电负性大而半径小的O原子,但是没有跟O原子直接相连的H,故乙醛自身分子间难以形成氢键,所以跟乙醇(沸点78.5℃)相比,乙醛的沸点很低,只有不到21℃;但是,乙醛分子里的这个O可以跟水分子的H形成氢键,所以乙醛能够以任意比例与H2O互溶。
第三,对液体物质的粘度(流动性)有影响。
我们知道,硫酸是一种油状液体,这说明它的流动性较差,粘度相对较大。这是为什么呢?曾有人猜测跟硫酸密度大有关系,其实不然。
比如,CCl4的密度很大,但是CCl4的流动性比硫酸、甚至比水都要好很多。
硫酸等作为小分子化合物,粘度大、流动性差,正是由于分子间氢键较强的缘故。
另外,氢键的形成还会使一些小分子物质在蒸气中呈现二聚甚至多聚分子。
比如水蒸气里大量存在着二聚物(H2O)2甚至三聚物(H2O)3等;醋酸蒸气中含有二聚分子(CH3COOH)2。
像硫酸这样,日常用品中,蜂蜜、糖浆、鸡蛋清等都呈粘稠状,也跟分子间氢键有关。
3.理论上讲,氢键强度应该是F—H…F > O—H…O,但沸点却是H2O > HF。这如何理解?
让我们试着从微观层面来分析这个问题。
HF分子中,虽然F原子最外层有3个孤对电子,但是每个HF分子只有一个H,故每个HF只能参与形成2个氢键,平均每个HF分子至多形成一个氢键(参见下图左)。
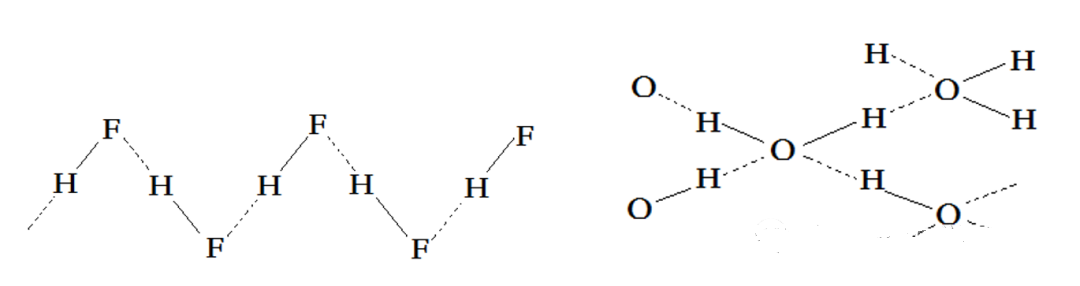
而H2O不然,其O原子有2个孤对电子,且每个H2O分子有2个H原子,通过上图(右)可以看到,每个H2O可参与4个氢键的形成,平均每个H2O可形成2个氢键。
也就是说,水中氢键的密度要远大于液态HF中的氢键密度。
这样,破坏H2O分子间氢键需要的能量就比破坏HF分子间氢键需要的能量多。
4.分子内氢键是怎么一回事?
一些较大的分子中,若同时含有N、O、F原子以及跟这些原子直接相连的H,则可能形成分子内氢键。
众所周知,生物大分子淀粉、纤维素、蛋白质、核酸等均以螺旋(双螺旋)形式存在,其重要原因就是这些高分子内的链节上有规律地排列的羟基(-OH)、氨基(-NH2)等,它们之间相互通过氢键作用,使得分子发生了卷曲。
对于一些小分子化合物来说,如果形成分子内氢键,则往往因此影响了分子间氢键的强度,致使其熔点、沸点降低。
无机化学里常常用分子内氢键学说解释HNO3的沸点比水低。
硝酸的结构为HO—NO2,因只有一个可形成氢键的H,这个H可能与分子内的氧原子间形成氢键(下图所示),于是影响了分子间氢键的强度。故HNO3的沸点并不是非常高(83℃,这比相对分子质量比它还小的水的沸点要低一些)。
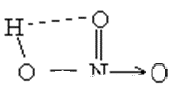
再如邻羟基苯甲醛和对羟基苯甲醛:
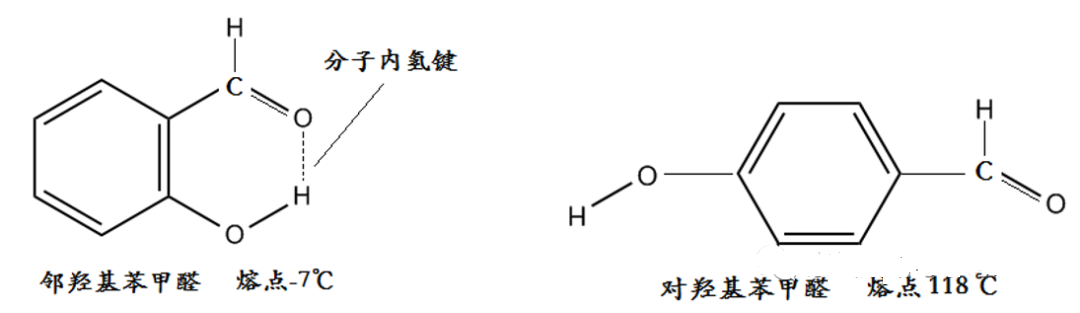
二者互为同分异构体,但熔点差异巨大。
原因在于,邻羟基苯甲醛易形成分子内氢键,导致分子间氢键大为减弱,故熔点显著低于对羟基苯甲醛。
另外,如果溶质分子形成分子内氢键,则往往使其在水中的溶解度减小。
比如NaHCO3的溶解度就比Na2CO3小得多,这是因为,Na2CO3溶解后,Na+、CO32-可以分别跟水分子发生正常的作用形成水合离子;而HCO3-则不然,它自身可以形成如下“分子内氢键”(严格讲,并非分子内):
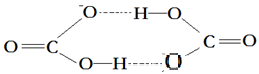
这严重影响了HCO3-与H2O间氢键的形成,故而NaHCO3的溶解度比Na2CO3显著减小。
另外,分子内氢键的形成对于物质的化学性质也会产生一定的影响。有兴趣的同学请在课外学习中留意此点。

- 全部评论(0)
