工艺流程题之萃取与反萃取
时间:2022-08-06 10:00 来源:未知 作者:化学自习室 点击: 次 所属专题: 萃取 反萃取
版权申明:凡是署名为“化学自习室”,意味着未能联系到原作者,请原作者看到后与我联系(邮箱:79248376@qq.com)!
一、萃取与分液
1、萃取的定义:
如果某物质在两种互不相溶的溶剂中的溶解度不同,则利用这种差别,可以使该物质从溶解度较小的溶剂中转移到溶解度较大的溶剂中去,这种方法叫做萃取,这种溶剂叫做萃取剂。
2、萃取剂选择的原则:
①溶质在萃取剂的溶解度要比在原溶剂(水)大
②萃取剂与原溶剂(水)不相溶且不反应
③萃取剂与溶质不反应
3、常见的萃取剂:CCl4(ρ>lg· cm-3); 苯(ρ<lg·cm-3); 汽油(ρ<lg·cm-3)
4、分液:将两种互不相溶、密度也不相同的液体分离开的操作方法
主要仪器:铁架台(含铁圈)、烧杯、分液漏斗
用四氯化碳萃取碘水中的碘
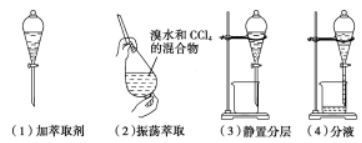
分液漏斗的使用
(1)检漏:分液漏斗使用之前必须检漏,检查分液漏斗颈上的玻璃塞与下面的活塞处是否漏水。
检漏的方法:往瓶内加入一定量的水,塞好瓶塞,用食指撼住瓶塞,另一只手控制活塞,倒立过来,观察 瓶塞周围是否漏水,如果不漏水,将瓶正立并将瓶塞旋紧180。后塞紧,仍把瓶倒立过来,再检查是否漏水。
(2)放液时,分液漏斗颈上的玻璃塞打开或使塞上的凹槽和小孔要对齐。
(3)分液时,下层液体从下口放出,上层液体从上口倒出,下端尖嘴处要紧靠烧杯内壁。
(4)萃取分液中的“4步操作”:加萃取剂一振荡放气一静置分层一分液。
二、反萃取
1、 概念:将目标产物从有机相转入水相的萃取操作称为反萃取,可看作是萃取的逆过程。
2、 目的:进一步纯化目标产物,将目标产物转移到水相。
对于一个完整的萃取过程,常常在萃取和反萃操作之间増加洗涤操作,洗涤操作的目的是除去与目标 产物同时萃取到有机相的杂质,提高反萃液中目标产物的纯度。洗涤出口溶液中含有少量目标产物,为提高收率,需将此溶液返回到萃取段。经过萃取、洗涤和反萃取操作,大部分目标产物进入到反萃相(第二水相),而大部分杂质则残留在萃取后的料海相(称作萃余相)。
3、 反萃取的教材介绍
在“海带提碘”的实验中,通常以四氯化碳为萃取剂对碘单质进行萃取、富集。那么,如何将碘单质从 碘的四氧化碳溶液中提取出来呢?
碘在77℃时较多地升华,所以在四氧化碳的沸点时,大部分的碘随着四氯化碳一起蒸出,常压蒸馏不能分离碘和四氯化碳。减压蒸馏可以分离,但通常在实验室不方便操作。因此,采用化学方法(NaOH浓溶液反萃取法或过氧化氢法)来分离碘和四氧化碳。
将富集在四氧化碳中的碘单质利用化学转化法重新富集在水中的方法即为反萃取法,如下图:

碘单质与浓NaOH溶流发生的反应为:3I2+6NaOH=5NaI + NaLO3+5H2O
水层加硫酸发生的反应为:5NaI+NaIO5+3H2SO4=3Na2SO4 + 3I2 + 3H2O
三、萃取与反萃取在金属元喪分离和富集中的应用
萃取剂主要在有色金属湿法冶金行业应用广泛,比如铜、锌、钴镍、镉、金银、铂系金属、稀土等行业。
金属萃取剂主要是一些常见的如磷酸、铵盐、苯等七种的氢离子或者羟基被一些长链烷基给取代。金属与这些萃取剂结合,就会变成金属有机化合物,而溶解于有机溶剂中。由于各种金属与这些萃取剂的结合能力不同,而导致这些萃取剂萃取金属的顺序不同,从而分离这些金属离子。
金属萃取剂萃取原理:利用两种互不相溶互不反应(微溶)的溶剂中溶解度或分配系数的不同,使化合物从一种溶剂内转移到另外一种溶剂中。经过反复多次萃取,将绝大部分的化合物提取出来。
无机离子一般易溶于水相,有机物易溶于有机相。比如说,氯离子,钙离子等都易溶于水,脂类易溶于丙酮或者醚类(乙醚石油醚)。有机相溶于醇类,但醇类中含有氢键有易溶于水。
溶剂萃取是基于有机溶剂对不同的金属离子具有不同的溶解因而对溶液中的金属离子可以进行富集与分离。例如含有机剂的有机相与含有金属离子的溶液相(也称水相)互相接触时,由于金属离子在两相中的溶解度不同而重新分配,从而实现一种金属在有机相中的富集并与其他杂质分离。
现以一种名为N-510的萃取剂对含铜溶液的萃取为例,来说明萃取的机理。N-510为羟胴型萃取剂, 全名叫2羟基-5仲辛基二甲苯甲酮肟,分子量为325。萃取时,它能与铜离子生成金属鳌合物,使铜被萃取,并析出氢离子。其反应可用下式表示:Cu2+(水相)+2RH (有机相) CuR (有机相)+2H+ (水相)上式反应是可逆的,在弱酸性介质中,由于反应生成的金属螯合物稳定性好,反应向右进行,即萃取反应。在强酸性介质中,上述反应向左进行,即螯合物的金属离子将会由有机相转入水相,有机相能获得再生,这叫“反萃取”反应。
CuR (有机相)+2H+ (水相)上式反应是可逆的,在弱酸性介质中,由于反应生成的金属螯合物稳定性好,反应向右进行,即萃取反应。在强酸性介质中,上述反应向左进行,即螯合物的金属离子将会由有机相转入水相,有机相能获得再生,这叫“反萃取”反应。
反萃取和洗脱:用一定的酸、碱或盐溶液把金属从有机相中再次转移到水相中。
四、典型例题
1、CoCl2·6H2O是一种饲料营养强化剂。一种利用水钴矿[主要成分为Co2O3、Co(OH)3,还含少量Fe2O3、Al2O3、MnO等]制取CoCl2·6H2O的工艺流程如下:

已知:①浸出液含有的阳离子主要有H+、Co2+、Fe2+、Mn2+、Al3+等;
②部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:
沉淀物 | Fe(OH)3 | Fe(OH)2 | Co(OH)2 | Al(OH)3 | Mn(OH)2 |
开始沉淀 | 2.7 | 7.6 | 7.6 | 4.0 | 7.7 |
完全沉淀 | 3.7 | 9.6 | 9.2 | 5.2 | 9.8 |
(1)写出浸出过程中Co2O3发生反应的离子方程式 。
(2)NaClO3的作用是 。
(3)加Na2CO3调pH至5.2所得沉淀为 。
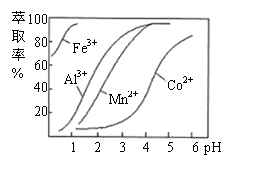
(4)萃取剂对金属离子的萃取率与pH的关系如图。
萃取剂的作用是 ;
其使用的较适宜pH范围是 。
A.2.0~2.5 B.3.0~3.5 C.4.0~4.5
(5)为测定粗产品中CoCl2·6H2O含量,称取一定质量的粗产品溶于水,加入足量AgNO3溶液,过滤、洗涤,将沉淀烘干后称其质量。通过计算发现粗产品中CoCl2·6H2O的质量分数大于100%,其原因可能是 。(答一条即可)
答案:
(1)Co2O3+SO32-+4H+=2Co2++SO42-+2H2O (2分)
(2)将Fe2+氧化成Fe3+ (2分)
(3)Fe(OH)3、Al(OH)3 (2分)
(4)除去溶液中的Mn2+ (2分) B (2分)
(5)粗产品中混有Cl-含量比样品高的可溶性氯化物或晶体失去了部分结晶水等 (2分)
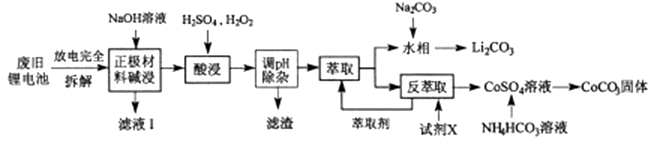
2.(2018·绵阳模拟)钴酸锂电池应用广泛,电池正极材料主要含有LiCoO2、导电剂乙炔黑、铝箔及少量Fe,可通过下列实验方法回收钴、锂。
几种金属离子沉淀完全(离子浓度为10-5mol/L)的pH如下表:
离子 | Fe3+ | Al3+ | Fe2+ | CO2+ |
溶液pH | 3.2 | 4.7 | 9.0 | 9.2 |
回答下列问题:
(1) LiCoO2中,Co元素的化合价为 ,滤液I的主要成分是 。
(2) 已知:氧化性Co3+>H2O2>Fe3+, “酸浸”过程中H2O2所起主要作用是。“调节pH”除去的离子主要有Al3+和 。
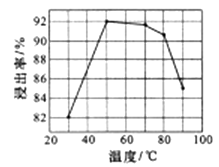
(3) 酸浸时浸出率随温度变化如图所示,温度升高至50℃以上时漫出率下降的原因是 。
(4) “萃取”和“反萃取“可简单表示为: Co2++2(HA)2 Co(HA2)2+2H+。则反萃取过程加入的试剂X是 。
Co(HA2)2+2H+。则反萃取过程加入的试剂X是 。
(5) 向CoSO4溶液中加入NH4HCO3溶液,发生反应的离子方程式为 。
【答案】
(1)加碱浸泡,铝和碱液反应生成偏铝酸盐和氢气,所以滤液中为NaAlO2及过量的NaOH ;
(2)由流程尾端可知要得到CO2,所以H2O2所起主要作用是还原Co2+,盐酸中Cl-有较强的还原性,能被氧化为Cl2,从而对空气造成污染,所以不能使用盐酸代替,由流程尾端可知铁离子已经在此步骤除去,且Al(OH)3和Fe(OH)3同样在水中溶解度较小;
(3)H2O2的分解为吸热反应,升高温度会促使H2O2分解速率加快,参与酸浸反应的H+的量减少,导致浸出率下降;
(4)反萃取需要提高氢离子浓度,根据生成硫酸钙物质,则X为硫酸;
(5)生成物中包含CoCO3,则反应方程式为:CoSO4+2NH4HCO3=COCO3↓+CO2↑+(NH4)2SO4+H2O,
则离子反应方程式为: Co2++2HCO3- =CoCO3↓+CO2↑+H2O

- 全部评论(0)
(2837288502) 评论 href="/plus/view.php?aid=20194">工艺流程题之萃取与:写的很好,谢谢
(2804366296) 评论 href="/plus/view.php?aid=20194">工艺流程题之萃取与:谢谢,我懂了
(852555251) 评论 href="/plus/view.php?aid=20194">工艺流程题之萃取与:hhh很不错
