离子极化对化合物颜色的影响
时间:2022-04-06 09:56 来源:未知 作者:化学自习室 点击: 次 所属专题: 离子极化 颜色
版权申明:凡是署名为“化学自习室”,意味着未能联系到原作者,请原作者看到后与我联系(邮箱:79248376@qq.com)!
离子极化会使化合物颜色加深。极化程度愈大,颜色愈深。
我们看到的物质五彩斑斓的颜色主要源自两类,一类是反射光显色,一类是发射光显色。离子极化导致的无机化合物颜色加深属于反射光显色。
反射光显色的原因是物质对光的选择性吸收。光是一种电磁波,可见光是波长在 390~770 nm 左右的复合光,大于 770nm 的红外光和小于 390nm 的紫外光是人类的眼睛看不到的。
一、无机化合物显色的常见原因
从物质结构的观点看,物质之所以能够吸收光线,主要是构成物质的微粒中的电子能够接收光的能量从能量较低的状态(基态)跃迁到能量比较高的状态(激发态),如果这部分能量(相当于基态到激发态的能量差)在可见光的范围内,可见光中对应波长的光因被吸收而缺失导致我们看到的不再是复合白光,而是剩余的那部分波长对应的颜色,也称为补色。

但是,如果物质全部吸收可见光、只吸收紫外光或红外光则我们看不到物质的颜色。
而且,可见光能量比较低,只能激发原子价层未配对的电子或未成键电子到能量差不太大的激发态,而原子内层、最外层已配对的电子和分子的成键电子对所处的状态比较稳定,其激发态与基态的能量差比较大,可见光难以激发这类电子。
二、荷移跃迁
对离子化合物来说,原子通过得失电子达到 8e 饱和结构,其最外层电子都已配对,因而通常呈无色。如果含有未键合的单电子则一般显色。
例如,ⅠA 和 ⅡA 的金属离子分别以 8e 形式存在,他们都具有最外层充满电子的稳定结构,其基态跃迁至激发态的能量差较大,属于紫外光范围,因此电子不能被可见光所激发,这些金属离子都是无色的。
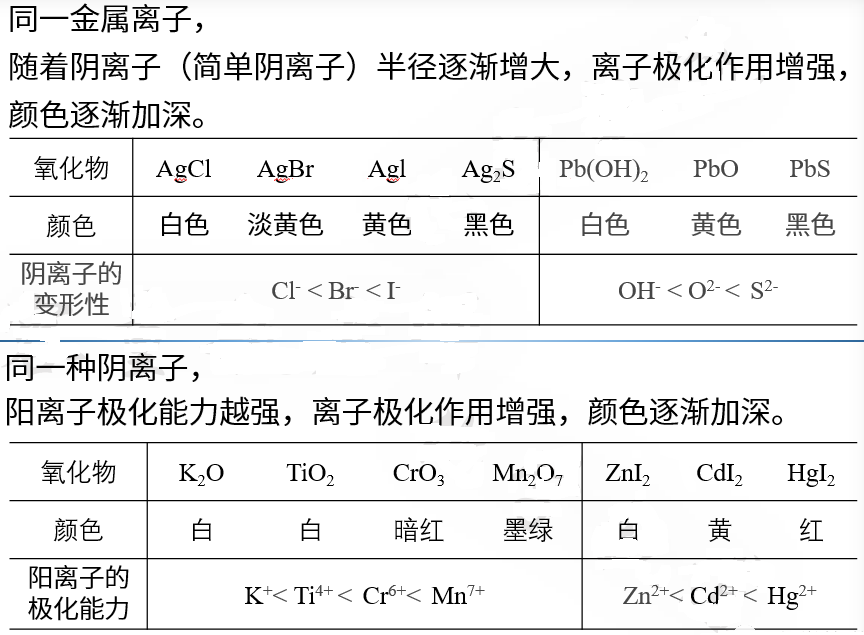
同样,呈现 ns2np6 构型的阴离子一般也是无色的,如 F-、Cl-、Br-、I-、O2-、S2- 等均无色。
18e 构型的阳离子,其最外层电子构型为 ns2np6nd10,看起来也是满壳层,与 8e 构型不同的是离子最外层 d 轨道上已经填满了电子,d 电子云的特殊性决定了 18e 构型的离子同时兼具很强的极化能力和变形性,所以18e 构型的阳离子形成的化合物容易发生附加离子极化。
附加离子极化的结果改变了离子化合物的电子云分布,使原本的离子键有向共价键转化,缩短了核间距,从而实际加强了离子间的结合力,降低了体系的势能。
因此,当有离子极化作用产生时,离子的基态和激发态的势能降低,但两者降低的幅度不同。由于能量高的激发态受核吸引力小,受极化的影响也大,能量降低的程度更大。而基态的能量受离子极化的影响小,能量减低的幅度较小。
当阳离子的激发态低于阴离子的激发态时,变形性大的阴离子接受可见光照射后能够给出孤电子对跃迁到阳离子的激发态,发生了从阴离子到阳离子的电荷迁移从而使物质显色。
这就是离子极化导致的荷移跃迁。例如 AgI 黄色,HgS 红色等。
三、离子极化对无机化合物颜色的影响规律
1. 离子的极化能力越强、变形性越大,附加极化作用越强,颜色越深。
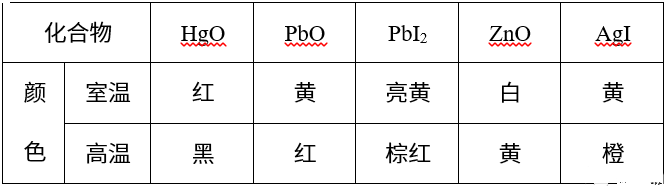
2. 温度的影响
无机化合物的颜色往往随温度升高而逐渐加深。
从离子极化的角度来看,温度升高,离子振动加剧,离子间接近的机会增多,离子间相互极化作用加强,促进了物质微观晶体结构的改变,同时使激发态与基态的能级差减小,外层电子跃迁所吸收可见光波长变长,因此颜色变深(向短波长处移动);而且,温度升高也使处于 “活化” 状态的价层电子增多,更容易被激发,所以化合物就更容易呈现较深的颜色。

- 全部评论(0)
