臭氧分子中的化学键是极性键还是非极性键?
时间:2021-11-09 16:27 来源:未知 作者:王笃年 点击:次 所属专题: 臭氧
版权申明:凡是署名为“化学自习室”,意味着未能联系到原作者,请原作者看到后与我联系(邮箱:79248376@qq.com)!
现代科学方法已经证实,臭氧分子(O3)是1个极性分子,那么其中的2个共价键当然是极性键,如果1个分子内的所有化学键均无极性,分子是不会显示极性的,因为分子极性(用偶极矩表示)实际上是分子内各键极性的矢量和。
有人在研究极性键、非极性键概念时,简单地给出这样的判断依据“同种元素原子间形成的键为非极性键”,这种以偏概全的总结是不合理的。
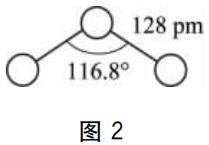
首先从臭氧分子来看:现代科学实验已经表明,O3分子具有V型结构(图2所示),键长为128pm ,键角为116.8°,分子偶极矩μ=0.50cm.
让我们从分子内化学键的角度对此加以理解:O原子取sp2杂化,中间氧原子的2个单电子均位于sp2杂化轨道,未参与杂化的2p轨道上有1对电子;而两侧的O原子的单电子则只有1个在杂化轨道上,另外2个杂化轨道均被电子对占用,另一个单电子位于未杂化的2p轨道上。中心氧原子分别用单电子和两侧氧原子的单电子形成σ键后,3个氧原子未杂化的2p轨道相互平行,从侧面发生电子云重叠,形成1个三中心、四电子的大π键(图3中虚线所示)。
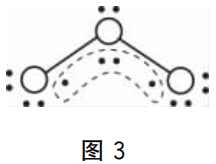
理论上讲,π键上的电子云是均匀分布的,但是3个原子对此π键的贡献不同,中间氧原子提供了2个电子,两侧的氧原子分别只提供了1个电子,最终电子云均匀化的结果是中间氧原子的电子云向两侧偏移了,所以导致臭氧分子中键具有极性。
“同种元素原子间形成的键为非极性键”这句话是不正确的,除臭氧分子外,还可以举出一些例子。比如乙醇 CH3—CH2—OH分子内的 C— C 单键,它受到—OH氧原子的吸电子作用影响,其电子对偏离左侧碳原子、偏向右侧碳原子,使得同是碳原子形成的键呈现一定极性。
(责任编辑:化学自习室)

说点什么吧
- 全部评论(0)
还没有评论,快来抢沙发吧!
