物质结构推断题题眼举例
时间:2022-05-18 08:48 来源:未知 作者:马会林 点击: 次 所属专题: 元素推断突破口
版权申明:凡是署名为“化学自习室”,意味着未能联系到原作者,请原作者看到后与我联系(邮箱:79248376@qq.com)!
元素推断题是历年高考命题的热点题目,是 对物质结构、元素周期律部分知识的综合考查,在新课标中新增的电子排布式、氢键、电负性、电离能、杂化理论等知识又是新课表高考命题的新宠。 笔者现就新课标高考元素推断题“题眼”归纳整 理如下。 '
一、元素周期表的结构
1. 元素周期表共七个周期,其中一、二、三周 期为短周期,四、五、六周期为长周期,第七周期未 排满,称为不完全周期。其各周期所容纳的元素 种数分别为2、8、8、18、18、32、32种。可归纳为: 当周期序数几为奇数时,此周期所容纳的元素种 数是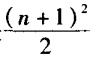 ;当周期序数为偶数时,此周期所 容纳的元素种数是
;当周期序数为偶数时,此周期所 容纳的元素种数是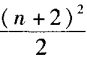 。因此第八周期所容 纳的元素种数是
。因此第八周期所容 纳的元素种数是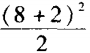 =50种。
=50种。
2. 元素周期表共18纵行,分为16个族,其中第1、第2、第13-17纵行为第IA~VIA7个主 族,第11、第12、第3 ~7纵行为第IB ~ ⅦB 7个 副族,第8、9、10三纵行为Ⅷ族,第18纵行为零族。
(1) 同周期相邻主族元素的原子序数相差1 或11(第四、第五周期的ⅡA和ⅢA元素)或25 (第六周期的ⅡA和ⅢA元素)。
(2) 同主族相邻周期主族元素原子序数相差 可能为2、8、18或32。其中IA、ⅡA族,同主 族、相邻周期元素原子序数之差为上一周期元素 所在周期中容纳的元素种数;ⅢA - VIIA族,同主 族、相邻周期元素原子序数之差为下一周期元素所在周期中容纳的元素种数。
3. 元素周期表中元素的“外围电子排布”又称价电子,按其差异可将周期表分为s区 (ns1~2 ) 、 p 区(ns2np1~6 ) , d 区(n - 1 ) d1~3 ns2、 (n - 1)d5ns1和(n - 1 ) d5~8ns1, ds 区(n - 1 ) d10 ns1~2)、f 区五个区,d区、ds区、f 区的元素统称为 过渡元素。
二、题眼归纳
1. 周期表的结构与电子层结构关系方面的 “题眼”
重要关系:主族元素的周期序数=核外电子 层数;主族序数=最外层电子数=最高正价数;
∣主族元素的负化合价∣=8 -主族序数=8-最高正价数。
(1) 主族序数等于周期数的元素是H、Be、 Al、Ge 等。
(2) 族序数等于周期数2倍的元素是C、S。
(3) 族序数等于周期数3倍的元素是O。
(4) 周期数是族序数2倍的元素是Li、Ca。
(5) 周期数是族序数3倍的元素是Na、Ba。
(6) 短周期中最高正价与负价代数和为零的元素是H、C、Si。
(7) 最高正价不等于族序数的元素是O、F。
(8) 不易表现正价的元素是O、F。
(9) 最高正价是最低负价绝对值3倍的元素 是S。
(10) 除H外,所有元素中原子半径最小的元 素是F,短周期中Na的原子半径最大。
2. 核外电子排布规律方面的“题眼”
(1) 最外层电子数等于或大于3(小于8)的 一定是主族元素。
(2) 最外层有1个或2个电子,则可能是IA、 ⅡA族元素又可能是副族、Ⅷ族或0族元素。
(3) 最外层电子数比次外层电子数多的元素 一定位于第二周期。
(4) 某元素阴离子的最外层电子数与次外层 电子数相等,该元素位于第三周期,可能是S或 C1;若为阳离子,则位于第四周期,可能是K或 Ca。
(5) 短周期元素中核外电子排布达到半满的元素有H、Li、N、P。
(6) 短周期元素中,价电子排布为ns2np2的 元素其第«电子层上的成对电子数等于未成对电 子数,即C和Si ;价电子排布为ns2np1和ns2np4的元素其第n电子层上的成对电子数是未成对电子数的2倍,即B、A1和O、S。
(7) 与氖原子电子层结构相同的阴离子有: N3-、O2-、F-(对应元素与氖元素位于同周期); 阳离子有:Na+、Mg2+、Al3+ (对应元素在氖元素的下一周期)。
(8) 与氩原子电子层相同的阴离子有:S2-、 Cl-(对应元素与氩元素位于同周期);阳离子有: K+、Ca2+(对应元素在氩元素的下一周期)。
(9) 常见的10电子微粒:阴离子有N3-、O2-、 F-、OH-、NH4+ ;阳离子有 Na+、Mg2+、Al3+、NH4+、 H3O+;中性分子有Ne、HF、H2O、NH3、CH4。
(10) 常见的18电子微粒:阴离子有S2-, Cl-、O22-、HS-;阳离子有K+、Ca2+ ;中性分子有 Ar、HC1、H2S, PH3、SiH4、H2O2、C2H6、N2H4、CH3OH、CH3F、CH3NH2。
3. 元素的存在、性质方面的“题眼”
(1) 形成化合物种类最多的元素、单质是自然界硬度最大的元素、形成的氢化物中含氢质量分数最大的元素是C。
(2) 地壳中含量最多的元素,或氢化物的沸 点最高的元素,或氢化物在通常情况下呈液态的元素是O。
(3) 气态氢化物的水溶液呈碱性的元素、空气中含量最多的元素、单质常作保护气且对环境 无污染的元素是N。
(4) 地壳中含量最多的金属元素是A1。
(5) 最活泼的非金属元素,或气态氢化物最 稳定的元素、或电负性最大的元素是F。
(6) 最活泼的金属元素,或最高价氧化物对 应的水化物碱性最强的元素,或阳离子氧化性最 弱的是Cs,在短周期中,最活泼的金属元素,或最高价氧化物对应的水化物碱性最强的元素,或阳离子氧化性最弱的是Na。
(7) 单质在常温下呈液态的金属是Hg,非金属是Br。
(8) 最高价含氧酸酸性最强的元素是C1。
(9) 短周期第一电离能最小的金属元素是Na;所有元素中电负性最大的元素是F。
(10) 最高价氧化物及其水化物既能溶于强酸,又能溶于强碱的元素是B、A1。
(11) 元素的气态氢化物和其最高价氧化物对应的水化物发生化合反应的元素是N。
(12) 元素的气态氢化物的水溶液呈碱性的元素是N。
(13) 两种元素的气态氢化物反应有白烟现象产生的是N和C1。
(14) 短周期元素中在常温下能与水反应放出气体的元素是Li、Na、F。
(15) 短周期元素中常见能形成同素异形体的元素有C(金刚石和石墨)、P(红磷和白磷)、O(氧气和臭氧等多种)。
(16) 通常单质呈红色的金属元素Cu;单质呈黄绿色气体的元素是C1;单质呈红棕色液体的元素是Br;单质为紫黑色固体的是I。
(17) 常温下在冷的浓硫酸和冷的浓硝酸中产生钝化现象的金属元素是Al、Fe。
(18) 短周期元素构成的物质具有漂白性的是Cl2,SO2,ClO2, HClO (NaClO, Na2O2,HNO3。
4. 其他方面的“题眼”
(1) 不含有化学键的单质是稀有气体元素的 原子。
(2) 短周期中两种元素既能按1: 1又能按 2: 1形成化合物的元素是H和O或Na和O。
(3) 通常短周期同主族的两种元素能形成化合物的元素是H和Li(或Na) ;C和Si ;O和S。
(4) 短周期中,三种元素形成的常见离子化 合物中既含有离子键又含有极性共价键的元素是 Na、O、H(NaOH);两种元素形成的常见离子化合 物中既含有离子键又含有非极性共价键的元素是Na、O(Na2O2);两种元素形成的常见共价化合物 中既含有极性共价键又含有非极性共价键的元素 是H、O(H2O2);元素形成的离子化合物中同时 含有离子键、极性共价键、非极性共价键和配位键 的元素是 N、H、F(或 S、C1)(如 NH4Cl)。
(5) 由于形成氢键使分子的沸点升高的元素 是 N、O、F。
(6) 常温下,单质是原子晶体的是C (金刚 石)、Si、B。
5. 化合物中中心原子的杂化方式及分子的空 间构型方面的“题眼”
杂化类型的判断方法:
(1) 公式:n=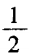 (中心原子的价电子数+配 位原子的成键电子数土电荷数)
(中心原子的价电子数+配 位原子的成键电子数土电荷数)
(2) 根据"值判断杂化类型
当 n =2,sp 杂化;n =3,sp2杂化;n = 4,sp3 杂 化。
(①当上述公式中电荷数为正值时取“ 电荷数为负值时取" +”;②当配位原子为氧原子 或硫原子时,成键电子数为0。)
例如:
SO2 n =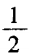 (6 +0) =3 sp2 杂化
(6 +0) =3 sp2 杂化
NO3- n = 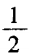 (5 + l) =3 sp2 杂化
(5 + l) =3 sp2 杂化
H2O n =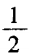 (6 +2) =4 sp3 杂化
(6 +2) =4 sp3 杂化
H3O+ n =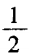 (6+3 - 1) =4 sp3杂化
(6+3 - 1) =4 sp3杂化
(3) 常见分子的杂化类型及空间构型
① sp杂化,分子构型为直线形的分子有: BeCl2 、CO2 、CS2
② sp2杂化,分子构型为平面三角形的分子 有:BF3、HCHO、SO3
③ sp2杂化,分子构型V形(或角形)的分子 有:SO2。
④ sp3杂化,分子构型为正四面体的分子有: CH4、CCl4、SiF4
⑤ sp3杂化,分子构型为V形(或角形)的分子有:H2O、H2S
⑥ sp3杂化,分子构型为三角锥形的分子有:NH3、PH3、AsH3、H3O+
三、例题分析
例1 (2007年海南卷)A、B、C、D、E代表5 种元素。请填空:
(DA元素基态原子的最外层有3个未成对 电子,次外层有2个电子,其元素符号为 ;
(2) B元素的负一价离子和C元素的正一价离子的电子层结构都与氯相同,B的元素符号为 ,C的元素符号为 ;
(3) D元素的正三价离子的3d亚层为半充满,D的元素符号为 ,其基态原子的电子排布 式为
(4) E元素基态原子的M层全充满,N层没 有成对电子,只有一个未成对电子,E的元素符号 为 ,其基态原子的电子排布式为 。
解析:
(1)4元素次外层有2个电子,最外层 有3个未成对电子,即L层的p亚层有3个未成 对电子的元素,则是N。
(2) B元素的负一价离子和C元素的正一价离子的电子层排布都是 18e-的离子,则B 是C1,C是K。
(3)2)元素的三 价离子的3d亚层为半充满,该三价离子的电子排 布式是1s22s22p63s23p63d5,其基态原子的电子排 布式为 1s22s22p63s23p63d64s2 或[Ar]3d64s2,该元素是Fe。
(4)由题知,E元素的基态原子的电子 排布是 1s22s22p63s23p63d104s1 或[Ar]3d104s1元素是Cu。
例2 (2008年宁夏卷)X、Y、Z、Q、E五种元 素中,X原子核外的M层中只看两对成对电子,Y 原子核外的L层电子数是K层的两倍,Z是地壳内含量(质量分数)最高的元素,Q的核电荷数是 X与Z的核电荷数之和,E在元素周期表的各元素中电负性最大。请回答下列问题:
(1) X、Y的元素符号依次为 、 ;
(2) XZ2与診2分子的立体结构分别是 和 ,相同条件下两者在水中的溶解度较大的是 (写分子式),理由是 ;
(3) 。的元素符号是 ,它位于第 周期,它的核外电子排布式为 ,在形成化合物时它的最高化合价为 ;
(4) 用氢键表示式写出E的氢化物溶液中存在的所有氢键 。
解析
由题意知:X原子的核外电子排布式 为1s22s22p63s23p4,则X是S;Y的核电荷数为6, 则Y是C;Z是地壳中含量最高的元素,则Z是 O;Q的核电荷数为24,则Q是Cr;E是元素周期表中电负性最大的元素,则E是F。则:(1)S C
(2) XZ2与YZ2分子式分别是SO2、CO2,它们的立体结构分别是V形、直线形;相同条件下两者在水中的溶解度较大的是SO2,因为CO2是非极性分子,SO2和H2O都是极性分子,根据“相似 相溶”原理,SO2在H2O中的溶解度较大。
(3) Q 的元素符号为Cr;它位于第四周期;它的核外电子徘布式为1s22s22p63s23p63d54s1;在形成化合物时它的最高化合价为+6。
(2) E的氢化物溶液中存在的所有氢键是F-H…F、F - H…O、O-H…F、O-H…O 。
例3 (2009年宁夏卷)已知X、丫和Z三种 元素的原子序数之和等于42。X元素原子的4p 轨道上有3个未成对电子,/元素原子的最外层 2p轨道上有2个未成对电子。X跟Y可形成化合物X2Y,Z元素可以形成负一价离子。请回答下列问题:
(1) X元素原子基态时的电子排布式为 ,该元素的符号是 ;
(2) Y元素原子的价层电子的轨道表示式为 ,该元素的名称是 ;
(3) X与Z可形成化合物XZ3,该化合物的空间构型为 ;
(4) 已知化合物X2Y3在稀硫酸溶液中可被金属锌还原为XZ3,产物还有ZnSO4和H2O,该反 应的化学方程式是 ;
(5) 比较X的氢化物与同族第二、第三周期元素所形成的氢化物稳定性、沸点高低并说明理由 。
解析:
X元素原子的4p轨道上有3个未成 对电子,可通过写电子排布式得到X为33号元素 As;Y元素原子的最外层2p轨道上有2个未成对 电子,同样根据电子排布式得到Y为O;再根据 X、Y和Z三种元素的原子序数之和等于42可得 到 Z 为 H。则: (1) 1s22s22p63s23p63d104s24p3 As
⑵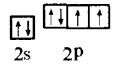 ,氧
,氧
(1) 三角锥
(2) As2O3+6Zn + 6H2SO4 =2AsH3 + 6ZnSO4 +3H2O
(3) 稳定性:NH3 > PH3 > AsH3 因为键长越 短,键能越大,化合物越稳定。
沸点:NH3> AsH3 > PH3,NH3可形成分子间氢键,沸点最高,AsH3相对分子质量比PH3大,分 子间作用力大,因而AsH3比PH3沸点高。

- 全部评论(0)
