不同环境中缺项氧化还原型离子方程式的配平技巧
时间:2022-07-21 15:39 来源:未知 作者:张迁 点击: 次 所属专题: 缺项方程式
版权申明:凡是署名为“化学自习室”,意味着未能联系到原作者,请原作者看到后与我联系(邮箱:79248376@qq.com)!
1 问题的提出
“氧化还原反应”在中学化学知识中占据着关键性位置,是电化学的基础,同时也与日常生活中诸多现象,如物质的燃烧、金属的冶炼、食物的保鲜等有着紧密的联系,属于化学核心概念。[1]笔者在教学中,发现多数同学对于缺项氧化还原离子方程式感觉很棘手,常常出错。所谓缺项氧化还原离子方程式,是指在给定氧化还原离子方程式中,不仅要配出氧化剂、还原剂、氧化产物、还原产物的系数,而且还需写出部分未参与电子转移的未知物质以及其系数,未知物质一般为H+、OH-和水,具体由环境的酸碱性决定。
配平缺项氧化还原离子方程式的难点在于,先要根据氧化还原理论,将氧化剂、还原剂、氧化产物、还原产物准确找出,再通过“电子守恒”配出相应的系数,然后再根据“电荷守恒”、所处环境来补充缺项物质,最后通过“原子守恒”配平总反应。故缺项氧化还原离子方程式考查的是学生的综合化学知识的掌握和运用。
2 知识储备
2.1 离子方程式的“三大守恒”
即“元素守恒”、“原子守恒”、“电荷守恒”,前两个守恒不做讨论。“电荷守恒”指的是离子方程式反应前所有离子所带电荷量(可以是个数、物质的量,也可以是物质的量浓度)的代数和与反应后所有离子所带电荷量的代数和相等。
2.2 氧化还原反应的标志与本质
氧化还原反应的标志是有元素化合价的升降,本质是有电子的转移。氧化还原反应方程式配平的关键就是氧化剂和还原剂中被还原和被氧化的元素化合价变化的数值相等,本质就是氧化剂得电子总数和还原剂失电子数相等相等。这是配平缺项氧化还原离子方程式的第一步,也是很重要的一步,相当于构建起了该方程式的配平框架。
2.3 酸性、碱性或中性环境的说明
①H+和OH-不能同时出现在同一个离子方程式中,因为H+和OH-不能在溶液中大量共存,二者的相互转化必须以水为中间过渡。
②酸性环境时,溶液中存在大量的H+,一般情况下配平时分为两种:加H+生成水,酸性减弱;加水生成H+,酸性增强。
③碱性环境时,溶液中存在大量的氢氧根,一般情况下配平时分为两种:加OH-生成水,碱性减弱;加水生成OH-,碱性增强。
④中性环境时,H+、OH-都不能大量存在,一般情况下配平时分为两种:加水生成H+,溶液呈酸性;加水生成OH-,溶液呈碱性。
⑤未说明环境时,须根据反应物、生成物在酸或碱性环境中能否稳定存在来判断。
⑥极特殊情况:在方程式的一边,即便补充H+或OH-满足了“电荷守恒”,但还是H或O原子还是不够,这时就应该补充H2O,因为在溶液中水作为溶剂,量可以认为是无限的。
3 配平技巧与实战演练
3.1 配平技巧
首先根据“电子守恒”将氧化剂、还原剂、氧化产物、还原产物及与它们相关的物质系数配好,然后计算反应前后的电荷数,根据电荷的电性和差值,选择在反应前或后补氢离子或氢氧根以保证前后离子所带电荷的数值相等,即“电荷守恒”,具体补氢离子还是氢氧根要根据溶液的酸碱性决定,最后通过“原子守恒”配平剩余物质。
3.2 实战演练
例1.配平该方程式___ClO3-+___Fe2++___═___Cl−+___Fe3++___
解析:如表1。
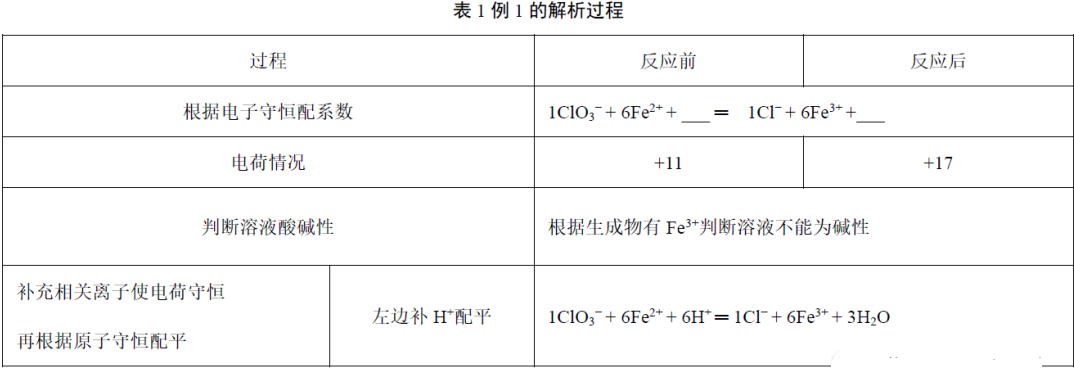 故正确答案为1ClO3-+ 6Fe2++ 6H+═1Cl−+ 6Fe3++ 3H2O,最终酸性减弱。
故正确答案为1ClO3-+ 6Fe2++ 6H+═1Cl−+ 6Fe3++ 3H2O,最终酸性减弱。
例2.配平该方程式___S2O52-+ ___I2+___ ═ ___SO42-+ ___I-+___(改编自2018年新课标全国I 27题)
解析:如表2。
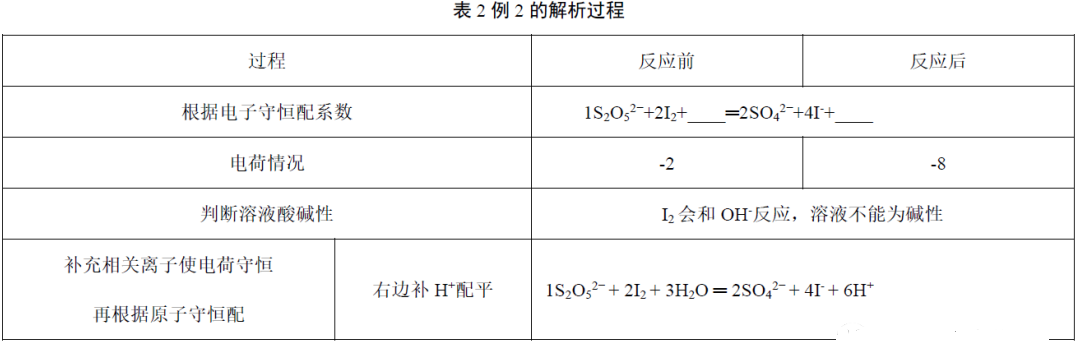
故正确答案为1S2O52-+ 2I2+3H2O═2SO42-+ 4I-+ 6H+,最终酸性增强。
例3.配平该方程式__NCl3+__ClO2-+ __ ═ __ClO2+__NH3+__Cl-+__(改编自2015年新课标全国II卷28题,)
解析:先标价态N由+3价变成-3价,NCl3中的Cl变为Cl-,价态不变,所以Cl-虽然不参与电子转移,但是可以根据NCl3的系数配出Cl-的系数。继续分析如表3。
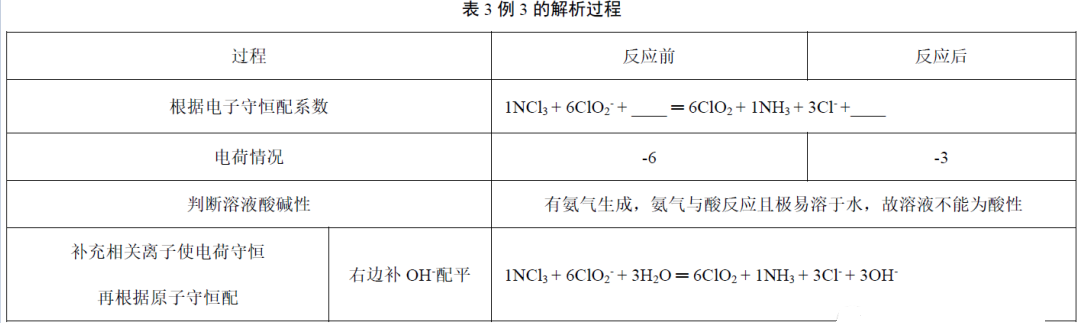
故正确答案为1NCl3+6ClO2-+3H2O ═ 6ClO2+1NH3+3Cl-+ 3OH-,最终碱性增强。
例4.配平该方程式___Al + ___ NO3-+ ___ = ___ AlO2-+ ___ N2↑+ ___(2019年长沙一中高一期末考试节选)
解析:如表4。
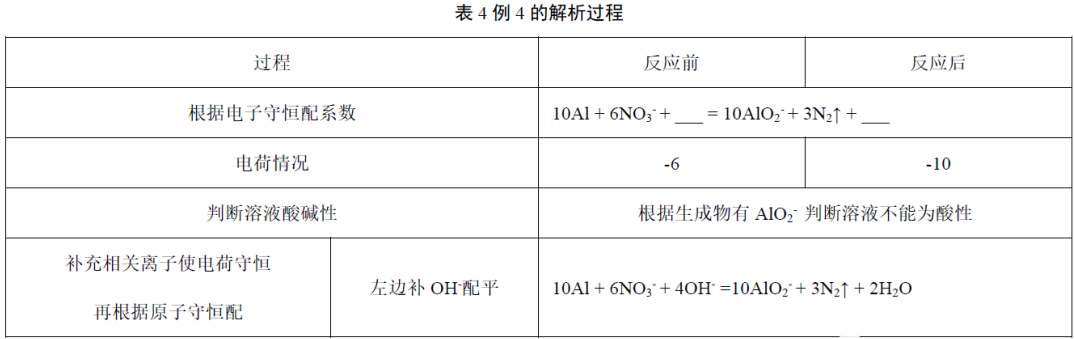
故正确答案为10Al + 6NO3-+ 4OH-=10AlO2-+ 3N2↑ + 2H2O,最终碱性减弱。
4 总结
综上可以看出,“不同环境中缺项氧化还原离子方程式的配平”这一类题型考查了包括氧化还原反应的配平、“电荷守恒”、溶液的酸碱性、离子共存等知识点,这就要求我们教师在日常的教学中,要注重夯实基础,有意识地进行知识融合,提高学生的审题能力和综合运用能力。

- 全部评论(0)
