得失电子守恒原理在氧化还原计算中的应用
时间:2022-08-03 17:25 来源:未知 作者:化学自习室 点击:次 所属专题: 守恒法 氧化还原反应计算
版权申明:凡是署名为“化学自习室”,意味着未能联系到原作者,请原作者看到后与我联系(邮箱:79248376@qq.com)!
得失电子守恒是氧化还原反应的核心,根据这一原理,既可配平氧化还原方程式,又可进行化学计算。其用于化学计算的最大优点是能简化过程,快速准确作答。下面谈谈后者。
一、确定氧化产物与还原产物的物质的量之比
例1 (NH4)2PtCl6晶体受热完全分解,生成氮气、氯气氢气体、氯化铵和金属铂。在此分解反应中,氧化产物与还原产物的物质的量之比为( )
A.1∶2 B.1∶3 C.2∶3 D.3∶2

选C。
练习1 硫酸铵在强热条件下分解,生成氨、二氧化硫、氮气和水。反应中生成的氧化产物和还原产物的物质的量之比是( )
A.1∶3 B.2∶3 C.1∶1 D.4∶3
二、确定氧化产物或还原产物中元素的化合价
例2 用Na2SO3还原MnO4-,如果还原含有2.4×10-3mol MnO4-的溶液时,消耗0.2mol/L 的Na2SO3溶液30mL,则锰元素在还原产物中的化合价是( )
A.+1 B.+2 C.+4 D.+5
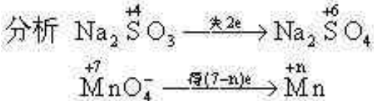
0.2 mol/L×30×10-3L×2=2.4×10-3mol×(7-n)
得n=2,选B。
练习2 某氧化剂XO(OH)2+可被亚硫酸钠还原到较低价态。如果还原含有2.4×10-3mol XO(OH)2+的溶液到较低价态,需用30mL 0.2mol/L 的Na2SO3溶液,则x元素的最终价态为( )。
A.+2 B.+1 C.0 D.-1
三、确定氧化产物或还原产物的化学式
例3 羟胺(NH2OH)是一种还原剂,能将某些氧化剂还原。现用25.00mL 0.049 mol/L 的羟胺的酸性溶液跟足量的硫酸铁溶液在煮沸条件下反应,生成的Fe2+恰好与24.65mL 0.020 mol/L 的KMnO4酸性溶液完全作用。已知(未配平):FeSO4+KMnO4+H2SO4→Fe2(SO4)3+K2SO4+MnSO4+H2O则在上述反应中,羟胺的氧化产物是( )。
A.N2 B.N2O C.NO D.NO2
分析 由题意知,KMnO4得到的电子数等于NH2OH失去的电子数。设产物中N为n价。
![]()
24.65mL×0.020 mol/L×5=25.00 mL×0.049 mol/L×(n+1)
得n=1
在四个选项中只有B符合,故应选B。
练习3 实验室将NaClO3和Na2SO3按物质的量之比为2∶1例入烧瓶中,同时滴入适量H2SO4,并用水浴加热,产生棕黄色的气体X,反应后测得NaClO3和Na2SO3恰好完全反应,则X为( )
A.Cl2 B.Cl2O C.ClO2 D.Cl2O3
四、确定氧化产物或还原产物的式量
例4 26g 锌和含63g HNO3的稀溶液正好反应,生成的还原产物的相对分子质量可能是( )
A.80 B.44 C.46 D.28
分析 锌与硝酸的物质的量之比为:

则有关系式:
![]()
在10mol HNO3中至少有8 mol HNO3肯定没发生价态变化,还有2mol HNO3共得8 mol 电子,氮元素的平均化合价降低4价,即在还原产物氮元素的平均化合价为+1价,是N2O或NH4NO3,相对分子质量为44或80。
选A、B。
五、确定氧化剂或还原剂的物质的量浓度
例5 将3.48g 四氧化三铁完全溶解在100mL 1mol/L 的硫酸中,然后加入K2Cr2O7溶液25mL,恰好使溶液中的Fe2+全部转化为Fe3+,且Cr2O72-全部还原为Cr3+。则K2Cr2O7溶液的物质的量浓度为( )。
A.0.05 mol/L B.0.1 mol/L C.0.2 mol/L D.0.3 mol/L
分析:
![]()
Fe3O4可以看作FeO·Fe2O3,则
n(Fe2+)=0.015mol
设K2Cr2O7溶液物质的量浓度为x。根据题意有:
![]()
0.015mol×1=25×10-3L×x×6
得x=0.1 mol/L
选B。
六、确定氧化剂或还原剂的物质的量浓度之比
例6 在相同体积的KI、Na2S、FeBr2溶液中,分别通入足量氯气充分反应后,若反应中耗去的氯气的物质的量相同,那么,KI、Na2S、FeBr2三种溶液的物质的量浓度之比为( )
A.6∶3∶2 B.2∶1∶2 C.4∶2∶3 D.3∶2∶1
分析: 耗去的Cl2量相同,说明KI、Na2S、FeBr2失去的电子数相等。有下列关系式成立:
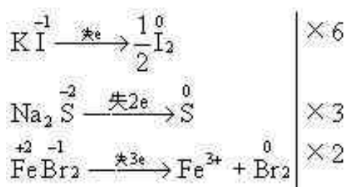
选A。
七、其它
例7 在11P+15CuSO4+24H2O=5Cu3P+6H3PO4+15H2SO4反应中,1 mol Cu2+能氧化P的物质的量是( )。

分析:
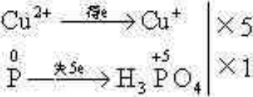
对应关系为5Cu2+—P。
选C。

- 全部评论(0)
