化学基本理论体系框架梳理及易错点
时间:2022-08-06 09:45 来源:未知 作者:化学自习室 点击: 次 所属专题: 易错点 基本理论
版权申明:凡是署名为“化学自习室”,意味着未能联系到原作者,请原作者看到后与我联系(邮箱:79248376@qq.com)!
一、氧化还原反应
(一)回扣要点知识
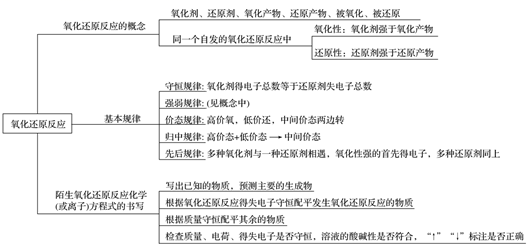
(二)辨析易混易错问题
判断下列说法是否正确,正确的打“√”,错误的打“×”,错误的指明原因。
(1)在氧化还原反应中有一种元素被氧化时,一定有另一种元素被还原()
(2)有单质参加或生成单质的反应一定属于氧化还原反应()
(3)某元素由游离态变成化合态时,该元素可能被氧化也可能被还原()
(4)阳离子只能得到电子被还原,阴离子只能失去电子被氧化()
(5)化合反应均为氧化还原反应()
(6)氧化还原反应中的反应物,不是氧化剂就是还原剂()
(7)含有最高价元素的化合物不一定具有强氧化性()
(8)物质氧化性的强弱不仅与物质的结构有关,还与反应物的浓度有关()
(9)在Cl2+H2O HCl+HClO中,氧化剂与还原剂均是Cl2,其物质的量之比为1∶1()
HCl+HClO中,氧化剂与还原剂均是Cl2,其物质的量之比为1∶1()
(10)3Cu+8HNO3(稀)===3Cu(NO3)2+2NO↑+4H2O中,氧化剂与还原剂之比为8∶3()
答案
(1)× 反例:Cl2的歧化反应(2)× 反例:同素异形体的相互转化(3)√(4)× 反例:Fe2+可被氧化为Fe3+(5)× 反例:Na2O+2O===2NaOH
(6)× 反例:Na2O2与H2O的反应中,水既不是氧化剂,也不是还原剂(7)√(8)√(9)√(10)× 反应中8个硝酸分子,只有两个参加氧化还原反应
二、物质结构与元素周期律
(一)回扣要点知识
1.物质的构成
原子、分子、离子都能直接构成物质。
(1)原子间通过共价键构成分子,如:N2、CO2、HCl、H2SO4、NH3、H2O。
注意①惰性气体是单原子分子,不存在共价键。
②NH3·H2O是共价分子,为纯净物;氨水是混合物。
(2)原子间通过共价键形成空间网状结构的一类物质,无分子,如:金刚石、SiO2等,只能称化学式。
(3)原子形成离子,阴、阳离子通过离子键形成的一类物质,无分子,如:NaCl、Na2O2、KOH、NH4Cl,只能称化学式。
(4)金属单质形成的晶体中有金属阳离子和自由移动的电子,没有阴离子。
2.物质结构决定物质的性质
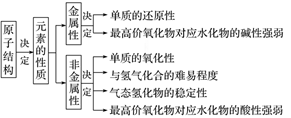
3.周期表的信息解读(四个关系式)
(1)电子层数=周期数。
(2)质子数=原子序数。
(3)最外层电子数=主族序数。
(4)主族元素的最高正价=族序数(O、F除外),负价=主族序数-8。
4.利用“三看”规律比较微粒半径大小
(1)“一看”是电子层数。当电子层数不同时,电子层数越多,半径越大。
(2)“二看”核电荷数。当电子层数相同时,核电荷数越大,半径越小。
如:r(O2-)>r(F-)>r(Na+)>r(Mg2+)>r(Al3+)。
(3)“三看”核外电子数。当电子层数和核电荷数均相同时,核外电子数越多,半径越大。
5.离子化合物和共价化合物与化学键的关系

(二)辨析易混易错问题
判断下列说法是否正确,正确的打“√”,错误的打“×”,错误的指明原因。
(1)H3O+与NH含有相同的电子数、质子数()
(2)最外层电子数为2的元素一定在第ⅡA族()
(3)硅、锗位于金属与非金属的交界线处,二者均可以制作半导体材料()
(4)第Ⅰa族元素的金属性一定比同周期的第Ⅱa族的强()
(5)第三周期元素的离子半径从左至右逐渐减小()
(6)气态氢化物的热稳定性:H2O>NH3>SiH4()
(7)碳酸的酸性强于次氯酸,因而碳的非金属性强于氯()
(8)非金属元素原子不可能形成离子化合物()
(9)同主族元素非金属性越强,其简单阴离子的还原性越强()
(10)三氟化硼分子中,B原子最外层满足8电子结构()
(11)第ⅠA族元素与第ⅦA族元素结合时,所形成的化学键都是离子键()
(12)NaCl晶体不导电,说明晶体中不含离子()
(13)SiO2分子中含有一个硅原子和两个氧原子()
(14)最外层电子数相同的元素,其化学性质一定相同()
答案:
(1)√(2)× 反例:He(3)√(4)√(5)× 反例:r(Cl-)>r(Al3+)(6)√(7)× 应比较最高价含氧酸的酸性(8)× 反例:NH4Cl(9)× 简单阴离子的还原性越弱(10)×BF3的电子式![]() (11)× 反例:HCl(12)×NaCl晶体中没有自由移动的离子(13)×SiO2晶体中不存在分子(14)× 反例:He、Mg最外层都是两个电子
(11)× 反例:HCl(12)×NaCl晶体中没有自由移动的离子(13)×SiO2晶体中不存在分子(14)× 反例:He、Mg最外层都是两个电子
三、化学反应速率及化学平衡
(一)回扣要点知识
1.化学反应速率
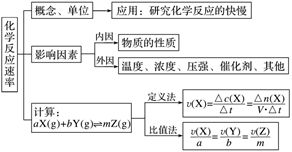
2.化学平衡
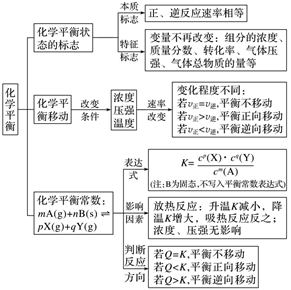
(二)辨析易混易错问题
1.判断下列说法是否正确,正确的打“√”,错误的打“×”
(1)已知乙酸与乙醇的酯化反应为放热反应,加入少量浓硫酸并加热,该反应的反应速率和平衡常数均增大()
(2)在恒温条件下,增大压强,化学反应速率一定加快()
(3)在一定条件下,增加反应物的量,化学反应速率一定加快()
(4)某温度时FeO(s)+CO(g) Fe(s)+CO2(g)达到平衡时n(CO)∶n(CO2)=4∶1。则该反应此温度时的平衡常数K=0.25()
Fe(s)+CO2(g)达到平衡时n(CO)∶n(CO2)=4∶1。则该反应此温度时的平衡常数K=0.25()
(5)正反应为吸热反应的可逆反应达到平衡时,升高温度,正反应速率增大,逆反应速率减小,平衡向正反应方向移动()
(6)加入催化剂加快了反应速率,改变了反应吸收或放出的热量()
(7)在一定条件下,平衡向正反应方向移动,正反应速率变大()
(8)在FeCl3+3KSCN Fe(SCN)3+3KCl平衡体系中,加入KCl固体,颜色变浅()
Fe(SCN)3+3KCl平衡体系中,加入KCl固体,颜色变浅()
(9)平衡向正反应方向移动,反应物的转化率都增大()
答案(1)×(2)×(3)×(4)√(5)×(6)×(7)×(8)×(9)×
四、电解质溶液
(一)回扣要点知识
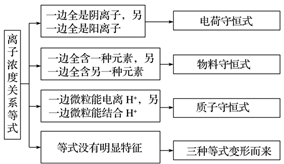
1.离子方程式书写注意事项
(1)易溶、易电离的物质(可溶性强电解质,包括强酸、强碱、可溶性盐)以实际参加反应的离子符号表示;非电解质、弱电解质、气体、单质、氧化物以及难溶盐均用化学式表示。
(2)HCO3-、HS-、HSO3-等弱酸的酸式酸根不能拆开写。
(3)浓硫酸不写离子符号;溶液中铵盐与碱反应加热放出NH3,不加热写成NH3·H2O;生成物中有微溶物析出时,微溶物写成化学式。
(4)盐类水解离子方程式一般用“ ”,不用“↑”和“↓”;若为完全进行的水解反应,用“===”,“↑”和“↓”;沉淀转化离子方程式用“===”,不用“↓”,可在难溶物后注“(s)”。
”,不用“↑”和“↓”;若为完全进行的水解反应,用“===”,“↑”和“↓”;沉淀转化离子方程式用“===”,不用“↓”,可在难溶物后注“(s)”。
(5)多步连续化学反应,如AlCl3与NaOH,NaAlO2与盐酸,Na2CO3与盐酸,CO2(SO2)通入NaOH溶液中等,此类反应可用分步书写再相加的方法,写出过量时的离子方程式。
2.弱电解质的电离平衡

3.离子浓度大小关系分析判断的基本解题框架
步骤一
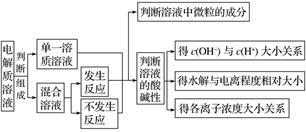
步骤二
(二)辨析易混易错问题
判断下列说法是否正确,正确的打“√”,错误的打“×”,错误的指明原因。
(1)任何温度下,根据水溶液中c(H+)和c(OH-)的相对大小都可判断溶液的酸碱性()
(2)pH=4的醋酸加水稀释过程中,所有离子浓度都降低()
(3)在NaHCO3溶液中加入NaOH溶液,不会影响离子的种类( )
(4)AgCl(s)溶解平衡常数表达式为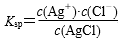 ( )
( )
(5)沉淀转化只能是Ksp大的沉淀转化为Ksp小的沉淀( )
(6)25 ℃时Cu(OH)2在水中的溶解度大于其在Cu(NO3)2溶液中的溶解度()
(7)中和等体积、等pH的盐酸和醋酸消耗的NaOH的量相同()
(8)制备无水AlCl3、FeCl3、CuCl2均不能采用将溶液直接蒸干的方法()
(9)某醋酸溶液的pH=a,将此溶液稀释10倍后,溶液的pH=b,则a<b<a+1()
(10)常温下,pH=5.6的CH3COOH与CH3COONa混合溶液中,c(Na+)>c(CH3COO-)()
(11)常温下,pH=7的氯化铵和氨水的混合溶液中,离子浓度顺序为c(NH4+)=c(Cl-)>c(OH-)=c(H+)( )
(12)常温下NaHSO4===Na++H++SO42-,pH=1的NaHSO4溶液中:c(H+)=c(SO42-)+c(OH-)()
(13)锅炉中沉积的CaSO4可用饱和Na2CO3溶液浸泡,再将不溶物用稀盐酸溶解除去()
(14)常温下,在NaHS溶液中滴入少量CuCl2溶液,产生黑色沉淀,水的电离程度增大()
(15)常温下,等体积的盐酸和CH3COOH的pH相同,由水电离出的c(H+)相同()
(16)0·2 mol·L-1CH3COONa与0.1mol·L-1盐酸等体积混合后的溶液中(pH<7):c(CH3COO-)>c(Cl-)>c(CH3COOH)>c(H+) ( )
(17)向0.10 mol·L-1NaHSO3溶液中通入NH3至溶液pH=7:则c(Na+)>c(SO42-)>c(NH4+)()
(18)nH4HSO4溶液中各离子浓度的大小关系是c(H+)>c(SO42-)>c(NH4+)>c(OH-)()
(19)0·1mol·L-1氨水中加入CH3COONH4固体,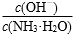 比值变大()
比值变大()
(20)用标准NaOH溶液滴定未知浓度的CH3COOH溶液到终点时,c(Na+)=c(CH3COO-)()
(21)25 ℃时,用0.01 mol·L-1盐酸滴定20 mL 某浓度的氨水时,应选用酚酞作为指示剂()
(22)向含AgCl、AgBr的浊液中加入少量AgNO3,溶液中 不变()
不变()
答案
(1)√(2)×c(H+)减小,C(OH-)增大(3)√(4)× 固体物质不写入平衡常数表达式(5)× 反例:BaSO4在饱和Na2CO3溶液中可转化为BaCO3
(6)√(7)× 醋酸的浓度大于盐酸,消耗NaOH的量较多(8)√(9)√(10)× 由于溶液显酸性,CH3COOH的电离程度大于CH3COONa的水解程度,因而c(CH3COO-)>c(Na+)(11)√(12)√(13)√(14)×HS-+Cu2+===CuS↓+H+,水的电离程度减小(15)√(16)√(17)√(18)√(19)×CH3COONH4电离的NH,抑制氨水的电离,c(OH-)减小,C(NH3·H2O)增大,因而比值减小(20)× 滴定终点为CH3COONa,CH3COO-水解,因而c(Na+)>C(CH3COO-)(21)× 盐酸滴定氨水,终点呈酸性,应选用甲基橙作指示剂(22)√
五、电化学原理
(一)回扣要点知识
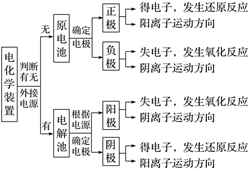
1.原电池、电解池的区别
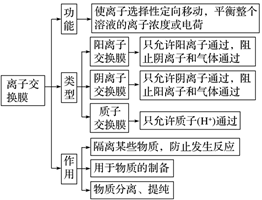
2.离子交换膜
3.电解原理的应用
(1)电镀:待镀件作阴极、镀层金属作阳极、含镀层金属阳离子的溶液作电镀液。
(2)电解精炼铜:纯铜作阴极、粗铜作阳极、硫酸铜溶液作电解质溶液。
4.金属(以铁为例)的电化学腐蚀与防护
(1)吸氧腐蚀电极反应:
负极:2Fe-4e-===2Fe2+;
正极:O2+4e-+2H2O===4OH-。
(2)防护方法:
①原电池原理——牺牲阳极的阴极保护法:与较活泼的金属相连,较活泼的金属作负极被腐蚀,被保护的金属作正极;
②电解池原理——外加电流的阴极保护法:被保护的金属与原电池负极相连,形成电解池,作阴极。
(二)辨析易混易错问题
1.判断下列说法是否正确,正确的打“√”,错误的打“×”
(1)Cu+2H+===Cu2++H2↑既可在原电池中完成,也可在电解池中完成()
(2)蓄电池充电时,标记着“-”的电极应与电源的负极相连()
(3)在Mg—Al—NaOH溶液组成的原电池中,因Mg比Al活泼,故Mg作负极()
(4)铅蓄电池放电时的负极和充电时的阴极均发生还原反应()
(5)电解质溶液导电的过程实际上就是电解的过程()
(6)电解时,电子流动路径是:负极→外电路→阴极→溶液→阳极→正极()
(7)用惰性电极电解MgCl2溶液时,阴极可能得到固体镁()
(8)用惰性电极电解KOH溶液时,阴极的电极反应式是O2+2H2O+4e-===4OH-()
(9)以Pt电极电解电解质溶液时,若两极只有H2和O2析出,则溶液的浓度一定改变()
(10)镀锌铁,若保护层被破坏后,就完全失去了对金属的保护作用()
答案 (1)×(2)√(3)×(4)×(5)√(6)×(7)×(8)×(9)×(10)×
六、化学反应与能量变化的关系
(一)回扣要点知识
1.牢记两类能量变化图像的含义
(1)反应热与物质具有的能量的关系
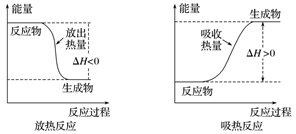
(2)反应热与正、逆反应活化能的关系
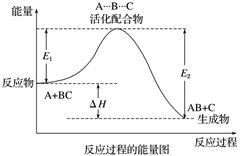
如图所示,E1表示正反应的活化能,E2表示逆反应的活化能,ΔH=E1-E2。
2.熟练掌握计算反应热的五种方法(根据条件作选择)
(1)根据热化学方程式计算:反应热与热化学方程式中各物质的物质的量成正比(Q=n·ΔH)。
(2)根据反应物和生成物的总能量计算:
ΔH=E生成物的总能量-E反应物的总能量。
(3)根据键能计算:
ΔH=E反应物键能之和-E生成物键能之和。
(4)根据物质燃烧热计算:Q=n(可燃物)×燃烧热。
(5)根据盖斯定律计算:①合理设计反应途径,如:
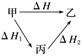
,则ΔH=ΔH1+ΔH2
②热化学方程式相加或相减,如:
(Ⅰ)C(s)+O2(g)===CO2(g) ΔH1
(Ⅱ)2CO(g)+O2(g)===2CO2(g) ΔH2
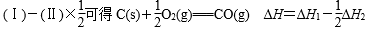
(二)辨析易混易错问题
判断下列说法是否正确,正确的打“√”,错误的打“×”
(1)吸热反应一定需要加热才能反应,而放热反应在常温下一定能进行()
(2)物质所含的键能越大,能量越低,该物质越稳定()
(3)H2(g)的燃烧热是285.8 kJ·mol-1,则2H2O(g)===2H2(g)+O2(g)ΔH=+571.6 kJ·mol-1()
(4)在常温常压下,2SO2(g)+O2(g)===2SO3(g)和2SO2(g)+O2(g) 2SO3(g)的ΔH相同()
2SO3(g)的ΔH相同()
(5)由石墨比金刚石稳定可推知:C(石墨)===C(金刚石)ΔH>0()
(6)等质量的硫蒸气和硫固体分别完全燃烧,相同条件下,前者放出的热量多()
(7)同温同压下,H2(g)+Cl2(g)===2HCl(g)在光照和点燃条件下的ΔH不同()
(8)H—H、O==O和O—H键的键能分别为436kJ·mol-1、496 kJ·mol-1和462 kJ·mol-1,则反应H2+1/2O2===H2O的ΔH=-916 kJ·mol-1()
(9)H2(g)+O2(g)===H2O(g)ΔH1和2H2O(g)===2H2(g)+O2(g)ΔH2中的ΔH2=2ΔH1()
(10)已知:
①I2(g)+H2(g) 2HI(g)ΔH=-9.48 kJ·mol-1
2HI(g)ΔH=-9.48 kJ·mol-1
②I2(g) I2(s)ΔH=-35.96 kJ·mol-1
I2(s)ΔH=-35.96 kJ·mol-1
则I2(s)+H2(g) 2HI(g)的ΔH=+26.48 kJ·mol-1()
2HI(g)的ΔH=+26.48 kJ·mol-1()
答案 (1)×(2)√(3)×(4)√(5)√(6)√(7)×(8)×(9)×(10)√

- 全部评论(0)
