你觉得最奇怪的化学元素是什么?
时间:2023-04-27 09:54 来源:未知 作者:化学自习室 点击: 次 所属专题: 化学元素概述
版权申明:凡是署名为“化学自习室”,意味着未能联系到原作者,请原作者看到后与我联系(邮箱:79248376@qq.com)!
1、氢太奇怪了。最外层就一个电子还抓着不放,这电负性也没多强(甚至比碳还弱)也抓着不放,宁愿在共价键中让电子偏向另一个原子,也不愿意像金属一样,洒脱地把电子放下,洒脱地成为阳离子。究其原因,就是因为,它就这一个电子了,如果再失去,就变成了光秃秃的质子了(可能带一两个中子可能不带,无关紧要),而这,是宇宙中最强的路易斯酸,势必不能在大量物质中稳定存在。这就造成了氢元素在共价化合物中绝无仅有的正电性,这也造就了一大批极性分子,以及氢元素特有的键——氢键,你可从没听过和氢键概念类似的什么硼键、碳键。可以说,没有氢键,就没有熔沸点如此高的水,也就没有了我们碳基生命。如果哪一天,宇宙中的氢元素被燃烧殆尽,我们熟知的碳基生命也就走到了尽头,智慧生物只能寻求别的形式得以存在。
2、氦太奇怪了。两个质子,一两个(通常是两个)中子,两个电子,就足以构成常态下最稳定、最惰性的简单系统。在其他原子都热烈地参与活泼的互动成键,甚至连氩氪氙这种社恐都愿意伸出成键之手时,我们的元素界老二,就大隐隐于市,作为与己无关的旁观者,在空气中静静地观察着这一切。他不能,也不需要其他元素的关心和爱。同时,在接近绝对零度的酷寒下,其他物质都冻得缩成了固体,只有氦,在常压下不仅仅不会凝固,而且还幽默地向世界展示出爬墙的能力。你说奇怪不奇怪?
3、锂太奇怪了。明明是碱金属,表面却总是覆盖着一层深色的普通氮化物;明明是碱金属,其和水的遇见却不那么地干柴烈火;明明是碱金属,碳酸盐在水中的溶解度却出奇地低;明明是碱金属,其某些化合物(如各种丁基锂)中,碱金属却不直接以阳离子的形式出现,而是像硼等缺电子元素一样形成n中心m电子键(n>m)。甚至,锂不如其下方的碱金属兄弟们那么活泼,却鸠占鹊巢般地独占着金属活动性顺序表的鳌头。这一切,其中一部分可能是因为,锂离子的个头太小了。或许也正是因为锂离子的轻盈,才能承担电荷运输的重任,在电池里为人类提供能量的源泉吧。
4、铍太奇怪了。明明是原子序数这么小、还是偶数号元素,它在宇宙、地壳中的丰度却如此地“感人”;一般来说剧毒的元素,都是铅、汞、铊、砷、钋、镉等大个头的重元素,然而铍以仅仅四个质子五个中子的小身板,居然也能跻身此列,并且,它还能用甜味作为致命的诱惑;作为一种金属,居然原子半径可以做到如此之小,导致其声学性能惊人,甚至还能填充在铜原子之间的间隙增强其力学性能;作为第2族的“碱土金属”,其氧化物居然还是两性的。怎么看,铍都是非常奇怪的一种元素,无论把它归到哪个族群,似乎都不具有这个族群的典型性质。
5、硼太奇怪了。自高中起,它就是化竞生的噩梦——由于其最外层只有3个电子,不足稳定“八隅体”的一半,却又不具有金属那极低的电负性,导致它在形成共价化合物时,总是捉襟见肘,用一般的方法总是凑不满稳定8电子。于是,它总是不满足于正常元素那一对一的亲密关系,总要把第三者拉进这个拮据的家庭,多个原子共享那仅有的少数电子,有时候就连氢这种只有一个电子的无辜路人也不能幸免于难。而硼的单质,其结构的复杂性更是难以形容,据说其一种晶型内部,便拥有15种不同结构的硼原子。而这奇怪的一切,本不应让一个简单到只有五个质子、五六个中子的硼原子承担的。
6、碳太奇怪了。且不说碳能形成一种很奇怪的单质,这种单质是大分子却晶莹剔透,原子核排列的紧密程度远胜其他所有单质和常见物质(原子密度达0.29mol/cm^3,单质第二名的硼才不到0.23mol/cm^3),不导电却极其能导热,其硬度就更不用说了,目前还没多少能比得过它的。其次,为碳为主链的化合物种类也是其他元素难以望其项背的——氮、氧等根本无法形成过长的链;硅等元素,由于硅硅键 键能不够,很难维持长链的稳定性;硫硒碲能形成长链了,却不能分支,只能望链兴叹;硼倒是可以形成复杂的氢化物,但是电负性过低,碰到氧气容易无脑地奉献出自己的生命。只有碳,位于一个恰到好处的位置,无论碳氢键,还是碳碳单、双、叁键,键能都比较高,能稳定存在,且不仅仅能成链,还能分支、成环,甚至形成笼状化合物,而这些烃,性质和氢气极其相似,在常温下对空气比较稳定。如果有一些氧、氮、硫等能形成极性的原子在碳和氢搭建的骨架中点缀几笔,则有画龙点睛的效果,让化合物增添几分生机和趣味。这些非凡的性质,在其他元素看来,难道不是一种奇怪却又令人羡慕的存在吗?而正是这种奇怪的元素,造就了蓝细菌,造就了花鸟鱼虫,造就了我们,也造就了各种塑料、纤维、染料、药品。如果没有这么奇怪的元素,这个世界将会是多么的死气沉沉!
7、氮太奇怪了。就说它的单质吧,我就没见过哪个电负性这么高的元素,单质还这么惰性的。周期表最右边那些社恐嘛,自己电子构型就能自给自足,情有可原;周期表中间偏下那堆高贵的金属嘛,他们摆出一副生人莫近的臭脸,也有他们自己的原因。而你氮嘛,堂堂全表电负性第三还是第四来着,不去和氟氧氯这三个大佬一样疯狂地抢电子内卷,反而和自己的一个同类躲进二人世界里,似乎这世界除了自己和另一半外再也没有烦恼,天雷滚滚、活泼金属现世、某含钼酶诱惑,乃敢与君绝。无处不在,却难以利用。再说它的化合物吧,某些化合物里的氮似乎对自己不在二人世界中这件事非常介意,动不动就用爆炸来抗议。另外氮似乎还有一个超级奇怪的怪癖,就是,它似乎很不介意自己的电子未成对,没有d区电子,没有f区电子,依然爱好形成奇数电子化合物,什么一氧化氮、二氧化氮,还有TEMPO(四甲基哌啶氮氧化物,可以百度一下)这种有机物,居然都是奇数个电子,真的能把强迫症逼死。不过我们的农作物生长,还真就离不开氮这种奇葩。
8、氧太奇怪了。先从单质说起吧,自古化学界就以冷色调为稀,甚至没有什么元素单质自己就是冷色调,氯是黄绿色仍然偏暖,碘是紫红色也不算冷色,锇倒是勉强算吧。但是氧这货,无论是液态O2,还是各种形态的O3,自己就是蓝色的。颜色奇怪也就算了,作为一种非金属性这么强的元素,居然还能和金属们一样有顺磁性,这就更奇怪了。再说化合物,之前已经有人说得很好了,氟作为非金属的老大,在提高元素氧化态的潜力这件事上,居然还不如老二氧,甚至可以说,没有氧元素,很多元素的最高氧化态将不复存在。然后咱一开始说氢的时候不是说过氢键吗,人家氮只有一对孤对电子,而氟氯的氢化物也只有一个氢,所以氢键形成的分子簇只能是树形的。唯独是氧你这小子,氢有俩,孤对电子也有俩,能形成错综复杂的大分子簇,这导致氧的氢化物熔点和沸点出奇的高,同时它的极性也是出奇的强,可以说仅次于离子液体吧。不过我们还真得感谢氧,如果没有这么奇怪的性质,我们就不会有性质这么优良的溶剂,也就是,我们赖以生存的水了。
9、氟太奇怪了,我就没见过抢电子抢得这么丧心病狂的。单质就不说了,有多恐怖我相信有点化学常识的人都知道,除了什么都不怕的氦氖氩,以及已经被充分氟化了的物质如萤石,也就只有镍铜合金能凭着一层致密氟化膜来幸免于难了,连氧这种流氓老二都有可能会被老大蹂躏至正价,这也导致了无数化学家为了她付出了宝贵的生命。就是它已经抢了电子满足了,变成-1价以后的化合物,仍然奇怪至极——本来卤化氢在水里就是完全电离的,但是到了氟这里,即使HF·H2O被完全电离成H3O+和F-后,氟离子也能凭着她那邪魅的魅力吸引得H3O+里的氢久久不肯离开,从而只能让整个水鎓离子和她自己牢牢绑定,无法成为自由之身,这也是稀氢氟酸被当成“弱酸”的原因。同时,氟离子和氟化氢分子那极其玲珑的身姿,甚至能穿透人体很多组织,这也是氢氟酸那极端危险性的原因。唉,真是一种致命的“奇怪”啊。
锝(Technetium),中国大陆称锝、港澳称鍀、台湾称鎝,来自Technetos(人造)。
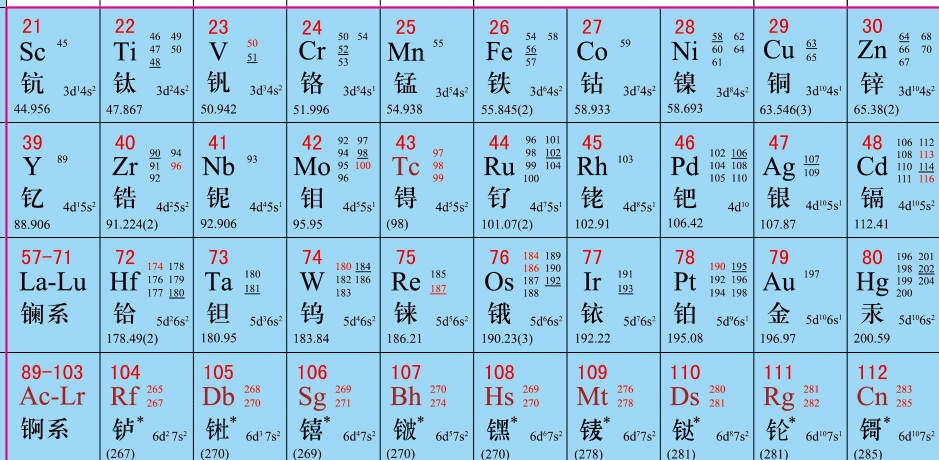
高中学化学的时候看元素周期表就觉得很奇怪,Tc为什么是红的。后来才知道,锝是地球上已知的最轻的没有稳定同位素的化学元素。门捷列夫在建立元素周期系的时候,曾经预言它的存在,命名它为eka-manganese(类锰),之后很多年里都没找到,被认为是“失踪了”的元素。针对这种现象,1924年前苏联学者苏卡列夫提出了同位素统计规则,在1934年被德国的马陶赫(Mattauch)确定,表述为:不能有核电荷数相差一个单位的两种稳定同质量素存在。从这条规则就是用来解释为什么43号元素锝和61号元素钷没有稳定同位素:分析一下42号钼和44号钌的稳定同位素,很容易就发现对于43号元素适当的原子量区间,已经被另外两种元素的稳定同位素占据了,它们是
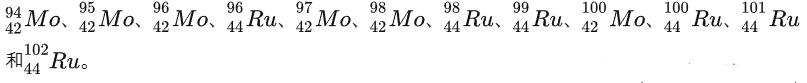
钷也是类似情况,也就是说他俩是被邻居“挤出”元素周期表的。所以不是这两个元素有意藏起来折磨化学家,而实在是它们的天然同位素足无立锥之地,这在元素周期表里可以说惨到奇怪了。一直要到1937年,才首次使用人工方法制取处来。那么Tc自然界到底有没有呢?其实还是有的[1]


- 全部评论(0)
