工业合成氨的两个问题答疑
时间:2023-04-28 11:02 来源:未知 作者:化学自习室 点击: 次 所属专题: 合成氨
版权申明:凡是署名为“化学自习室”,意味着未能联系到原作者,请原作者看到后与我联系(邮箱:79248376@qq.com)!
问题一:根据合成氨的反应方程式,N2和H2物质的量之比为1﹕3,但实际生产中,N2和H2物质的量之比为1﹕2. 8,即N2过量,原因是什么?
分析:工业合成氨时,使用的是铁催化剂,反应历程如下图所示:
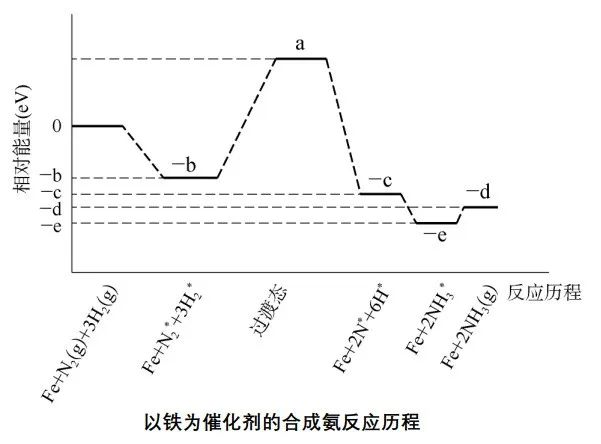
从图中可知,工业合成氨是多步进行的反应,其中氮气在催化剂上的吸附活化是总反应的控速步骤,总反应的速率是N2的吸附活化决定的,适当提高氮气的浓度,加快了这一步的反应速率,总反应速率也就加快了。
说明:有同学回答说,“因为原料气中N2相对易得,所以N2要过量”,这种说法是不妥的,在工业上,N2和H2的生产成本差别不大。
问题二:合成氨工业把氨液化分离出去,则反应速率是怎样变化的?
分析:由问题一可知,氮气在催化剂表面上的吸附活化是总反应的控速步骤,但当NH3浓度较大时,NH3分子将占据铁催化剂的活性位点,从而使N2难以吸附活化。当把NH3液化分离后,NH3在Fe 催化剂上及时脱附,有利于空出足够活性位点,从而使反应速率加快。
科学家结合实验与计算机模拟结果,研究了在铁催化剂表面上合成氨的反应历程,如图:
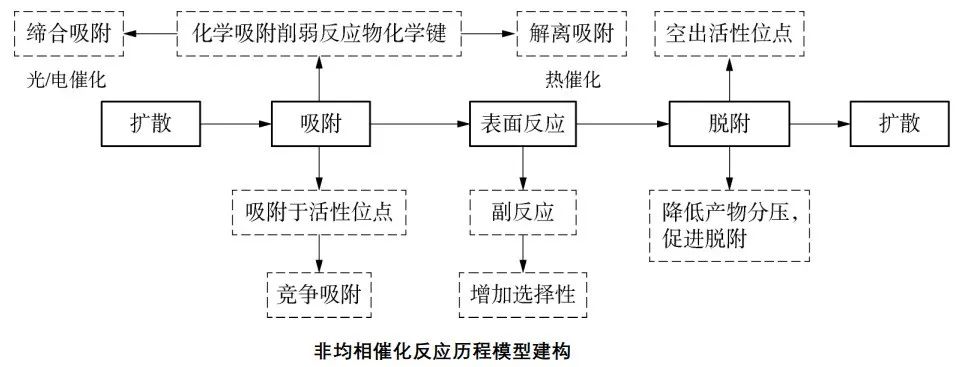
说明:有同学根据速率—时间图像分析,把NH3液化分离后,正反应速率先不变,再减小,逆反应速率先突然减小,再增大,新平衡的反应速率比原来的小。这种分析对于不使用催化剂的反应是正确的,但对于合成氨反应是错误的。
(责任编辑:化学自习室)

说点什么吧
- 全部评论(0)
还没有评论,快来抢沙发吧!
