工业生产中适宜生产条件的选择原则
时间:2023-05-16 11:15 来源:未知 作者:化学自习室 点击: 次 所属专题: 工业条件选择
版权申明:凡是署名为“化学自习室”,意味着未能联系到原作者,请原作者看到后与我联系(邮箱:79248376@qq.com)!
工业生产中适宜生产条件的选择原则:
(1)从化学反应速率分析:既不能过快,也不能太慢
(2)从化学平衡移动分析:既要注意外界条件对速率和平衡影响的一致性,又要注意两者影响的矛盾性。
(3)从原料的利用率分析:增加易得廉价原料,提高高价原料的利用率。
(4)从实际生产条件分析:如设备耐高温、高压的能力。
(5)从催化剂的活性分析:注意温度对催化剂活性的影响。
影响因素 | 有利于加快反应速率条件的调控 | 有利于平衡移动条件的调控 | 综合分析结果 | |
浓度 | 增大反应物浓度 | 增大反应物浓度、减小生成物浓度 | 不断补充反应物、分离出生成物 | |
压强(有气体参加) | 高压 | ΔV<0 | 高压 | 设备允许条件下尽量选择高压 |
ΔV>0 | 低压 | 兼顾速率和平衡选择适宜的压强 | ||
温度 | 高温 | ΔH<0 | 低温 | 兼顾速率和平衡、并考虑催化剂的适宜温度 |
ΔH>0 | 高温 | 设备允许条件下尽量选择高温,并选择合适催化剂 | ||
催化剂 | 选择合适的催化剂 | 无影响 | 选择适宜的催化剂,考虑催化剂活性与温度的关系 | |
【对点练习】
1.工业上主要利用碳热还原重晶石制得硫化钡,进而生产各种钡化合物。如图为不同反应温度下,实验中碳热还原硫酸钡反应体系的平衡组成随反应温度的变化关系。下列说法正确的是()
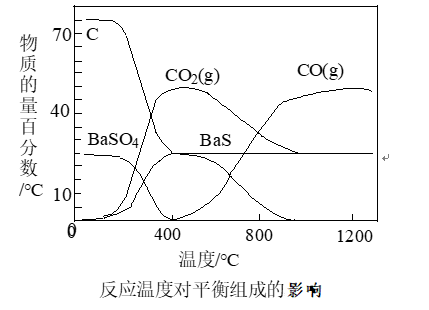
A.约150℃,体系中开始出现BaS,说明温度越高反应速率越快
B.400℃时发生的化学反应方程式:BaSO4十2C=BaS+ 2CO2↑
C.CO一定无法还原重晶石
D.温度高于400℃后,硫酸钡才能转化为BaS
【解析】根据图像,约在150 °C时,体系中开始出现BaS,说明在150 C开始反应,不能说明温度越高反应速率越快,故A错误;根据图像在400℃ BaSO4物质的量分数为0,C的物质的量百分数减小,BaS物质的量百分数增大,CO2的物质的量分数增大,因此400℃时反应物是BaSO4和C,生成物是CO2和BaS,反应方程式为BaSO4十2C=BaS+2CO2↑,故B正确;CO常作还原剂,能还原BaSO4,故C错误;根据图像,约在150 °C左右BaSO4转化成BaS,故D错误。
【答案】B
2.工业制硫酸生产流程如下图:
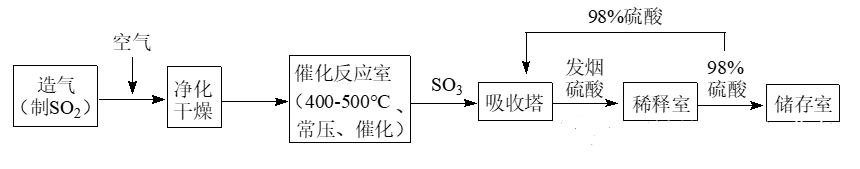
(1)实验室常用过量的氢氧化钠溶液吸收SO2尾气,该反应的离子方程式为________。
(2)已知SO2和O2生成SO3的反应过程放热。在催化反应室中,下列措施有利于提高SO2平衡转化率的有_______。(填写编号)
A.减少压强 B升高温度 C不断补充空气 D及时分离出SO3
(3)在工业制硫酸生产中,为提高催化剂效率采取的措施有_______(答出2点)。
【解答】
(1)过量NaOH溶液与SO2反应生成亚硫酸钠与水,离子方程式为SO2+2OH-=SO32-+H2O。
A.正反应方向气体体积减小,减小压强,化学平衡向逆反应方向移动,故A错误;
B.正反应方向放热,升高温度,化学平衡向逆反应方向移动,故B错误;
C.增大氧气浓度,化学平衡向右移动,故C正确;
D.减小生成物浓度,化学平衡向右移动,故D正确。
(3)提高催化剂效率可以通过净化气体、控制温度在400-500℃或是增大催化剂与反应气体的接触面积。
【答案】(1)SO2+2OH-=SO32-+H2O (2)CD (3)控制反应温度、对原料气进行净化
3.环戊烯是生产精细化工产品的重要中间体,其制备涉及的反应如下:
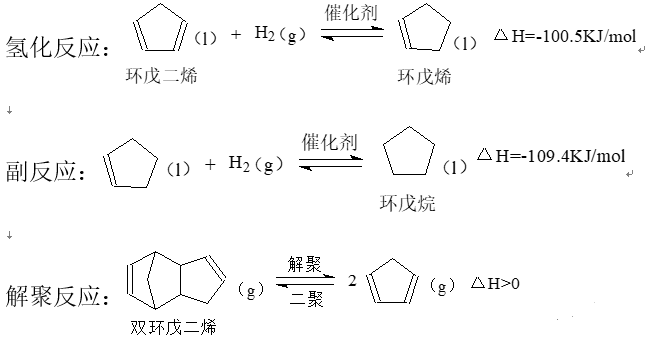
回答下列问题:
(1)一定条件下,将环戊二烯溶于有机溶剂进行氢化反应(不考虑二聚反应),反应过程中保持氢气压力不变,测得环戊烯和环戊烷的产率(以环戊二烯为原料计)随时间变化如图所示:
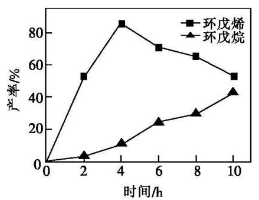
①0-4h氢化反应速率比副反应快的可能原因是______。
②最佳的反应时间为______h,若需迅速减慢甚至停止反应,可采取的措施有______(写一条即可)。
③一段时间后,环戊烯产率快速下降的原因可能是______。
(2)解聚反应在刚性容器中进行(不考虑氢化反应和副反应)。其他条件不变,有利于提高双环戊二烯平衡转化率的是______(填标号)。
A.增大双环戊二烯的用量 B使用催化剂 C.及时分离产物 D.适当提高温度
【解析】(2)①反应物浓度越大,该反应越易正向移动,0-4h氢化反应速率比副反应快的可能原因是反应物的浓度大,
②环戊烯的产率越大、环戊烷的产率越小越好,根据图知4H时环戊烯产率最大;若需迅速减慢甚至停止反应,可以通过减少反应物浓度或降低温度实现,所以排出氢气或急剧降温都能迅速减慢甚至停止反应,
③副反应能降低环戊烯的产率,所以一段时间后,环戊烯产率快速下降的原因可能是副反应增加,
(2)A增大双环戊二烯的用量,平衡正向移动但是其转化率降低,故A错误;B使用催化剂只改变化学反应速率不影响平衡移动,故B错误;C.及时分离产物,平衡正向移动提高双环戊二烯转化率,故C正确;D.适当提高温度平衡正向移动,双环戊二烯转化率升高,故D正确;
【答案】(1)①反应物的浓度大 ②4排出氢气或急剧降温③副反应增加(2)CD

- 全部评论(0)
