面心立方晶胞知识全解析
时间:2023-05-09 10:40 来源:未知 作者:化学自习室 点击: 次 所属专题: 面心立方最密堆积
版权申明:凡是署名为“化学自习室”,意味着未能联系到原作者,请原作者看到后与我联系(邮箱:79248376@qq.com)!
一、典型的金属晶体结构
结构特点:金属原子以金属键结合,即失去外层电子的金属离子与自由电子的相互吸引。金属键无饱和性和方向性,使金属内部原子呈紧密排列,形成对称性较高的密堆结构。
常见结构:
面心立方(A1或FCC):Cu、Ag、Au、Al、γ-Fe
体心立方(A2或BCC):Cr、V、α-Fe
密堆六方(A3或HCP):Be、Mg、Zn、Cd
本期讲解面心立方(A1或FCC)结构。
二、原子结构/原子数
FCC,即面心立方晶格(Face Center Cubic),是晶体结构的一种,其原子结构如图1所示。
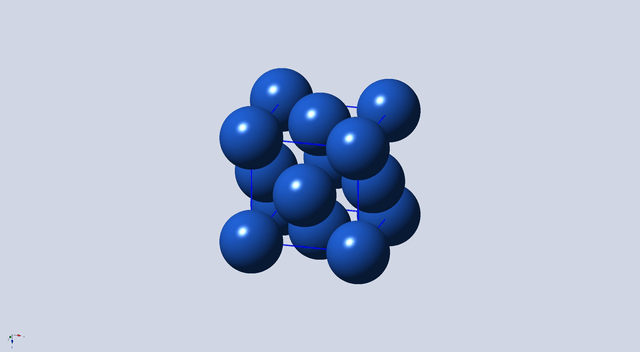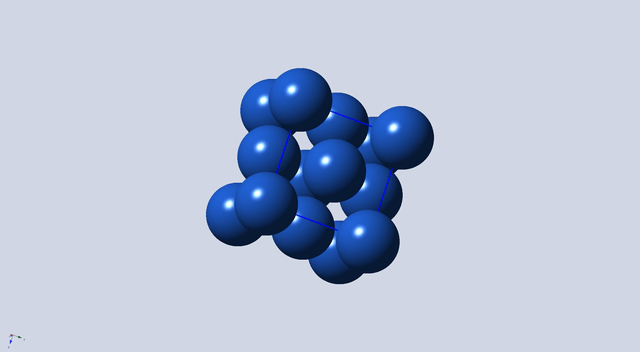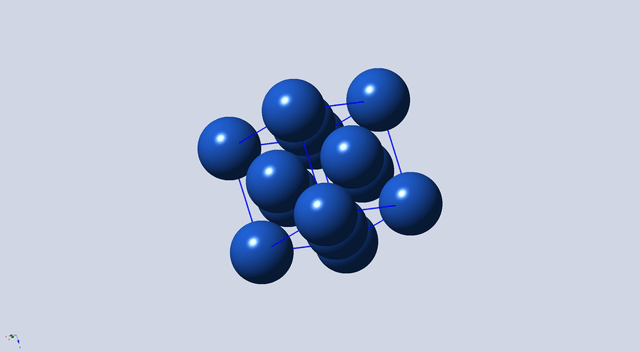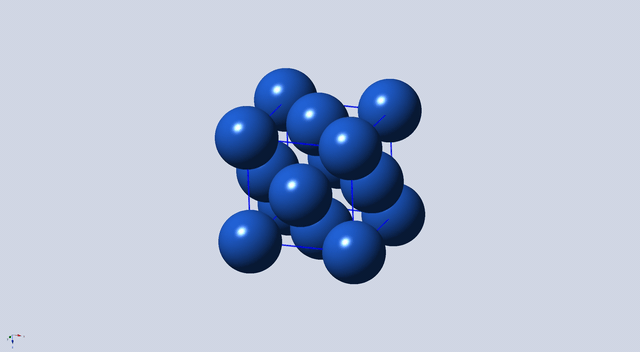
图1 面心立方晶胞
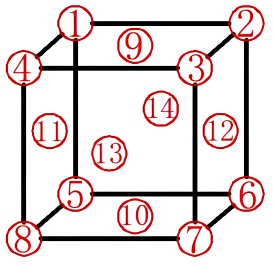
图2
如图2所示,位于顶点上的原子1~8属于该晶胞的部分为1/8,位于面上的原子9~14属于该晶胞的为1/2,故晶胞中原子数:
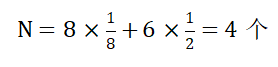
三、 原子半径
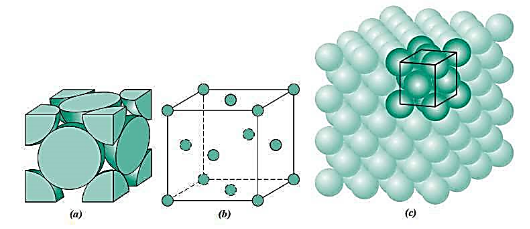
图3
如图3所示,位于面对角线上的三个原子相切,(面心上的原子与四个顶点处的原子均相切)从5-7号原子的距离相当于四个半径,所以,原子半径为:
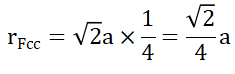
四、 配位数
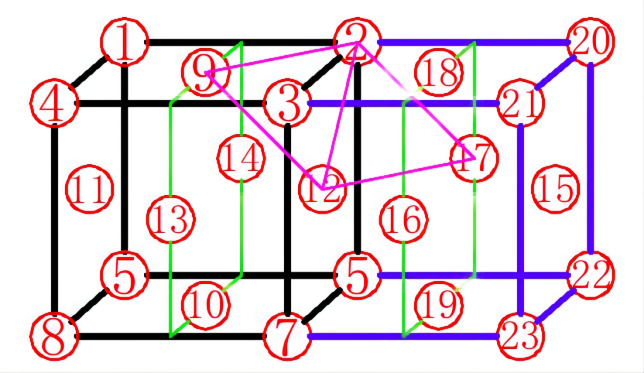
图4
如图4所示,与12号原子相距最近且距离相等的有2、3、5、7、9、10、13、14、16、17、18、19号共计2个原子,配位数为12
五、致密度
概念:晶体结构中原子体积占总体积的百分数,也叫空间利用率。
球体空间利用率(晶胞中原子体积与晶胞体积的比值)=紧密系数=堆积密度=致密度
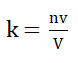
式中:n-晶胞中原子数,v-一个原子体积,V—晶胞体积。
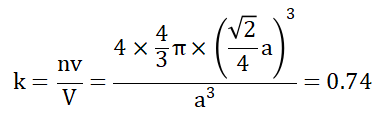
六、堆垛方式
对于面心立方结构而言,原子排列较为紧密的平面为垂直于立方体空间对角线的对角面。如图5所示,为了获得最紧密的排列,第二层密排面(B层1-3-8)的每个原子应当正好座落在下面一层(A层2-5-7)密排面的b组空隙(或c组)上,第三层密排面(C层)的每个原子中心不与第一层密排面的原子中心重复,而是位于既是第二层原子的空隙中心,又是第一层原子的空隙中心处。之后第四层原子中心与第一层的原子中心重复,第五层又与第二层重复,以此类推,堆垛方式为ABC ABC ABC...
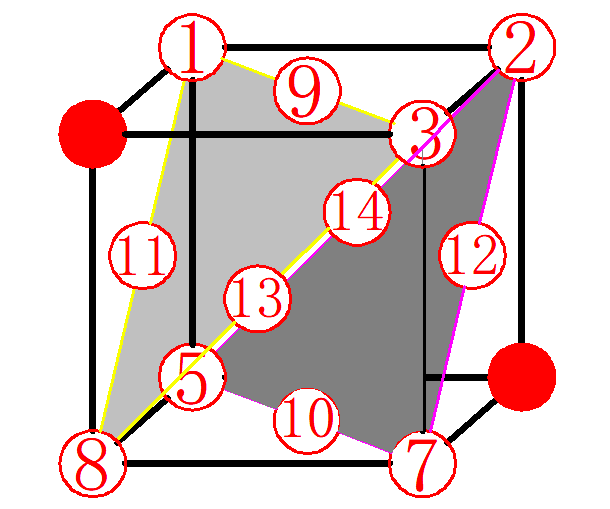
图5
七、密排面
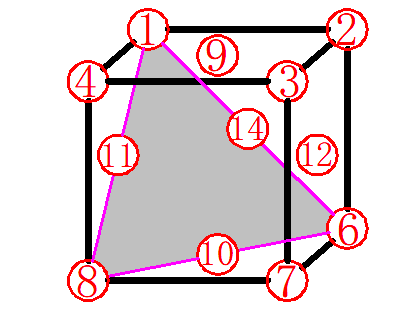
图6
如图6所示,面对角线上的原子相切,如1、14、6号原子相切,1、11、8号原子相切,8、6、10号原子相切,因此由这三条对角线组成的平面排列最紧密,称为密排面,表示为(111)。
八、密排方向
如图7所示,由于面对角线上的原子相切,因此面对角线的方向即为密排方向。如图中5-10-7号原子的方向,8-10-6号原子的方向。
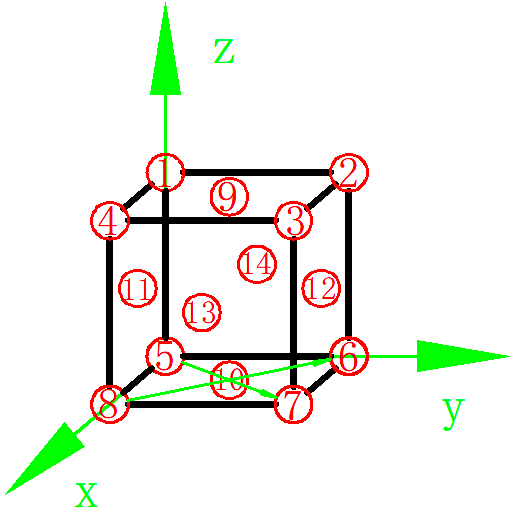
图7
九、四面体间隙
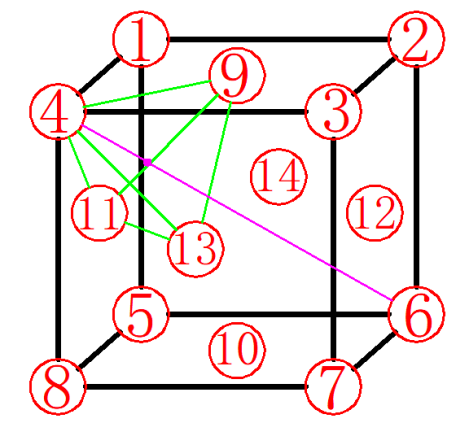
图8
确定间隙中心:四面体间隙由四个原子组成,如图8所示,四个原子分别为顶点处的4号原子和相邻三个面上的面心处的原子9、11、13。根据对称性可知间隙中心位于体对角线距离顶点处原子1/4处,如图9所示。
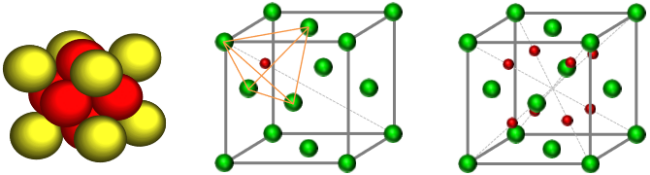
图9
确定间隙个数:每一个顶点均能形成一个四面体间隙,一个晶胞八个顶点共形成8个四面体间隙。
确定间隙半径:间隙中心与原子中心的距离为,所以间隙半径

十、八面体间隙
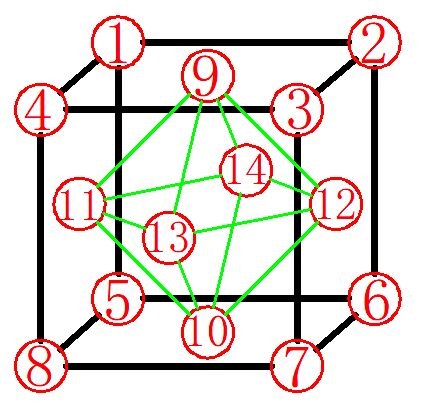
图10
确定间隙中心:八面体间隙外有8个面,8个面所围得的空间是空的,由6个原子组成,如图10所示,这六个原子分别为位于面心上的原子9、10、11、12、13、14。因此间隙中心就位于晶胞的体心位置,如图11所示。
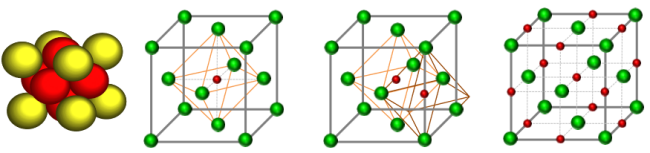
图11
确定间隙个数:9-10号原子的距离为棱长,也就是说每个棱长都对应着一个八面体间隙,一个晶胞12条棱,但是每条棱对应的八面体间隙只有1/4属于该晶胞,而中心处的八面体间隙则完全属于该晶胞,因此八面体间隙有12×1/4+1=4个。
确定间隙半径:间隙中心到原子中心的距离为,则间隙半径为:
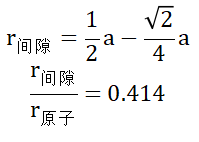
间隙部分比较复杂,我们再来看一下FCC四面体间隙和八面体间隙的动图演示,如图12所示。
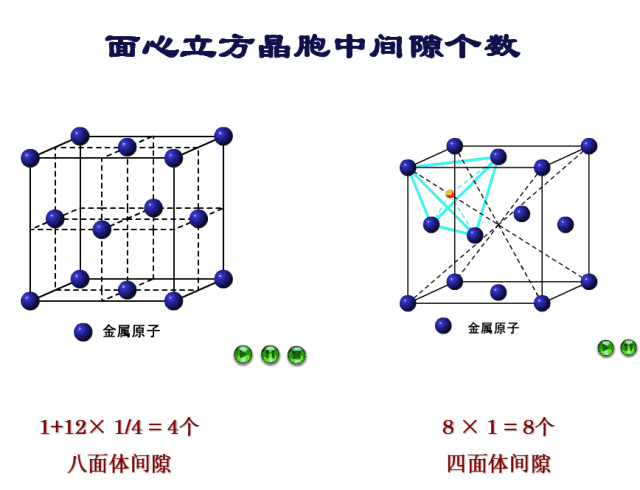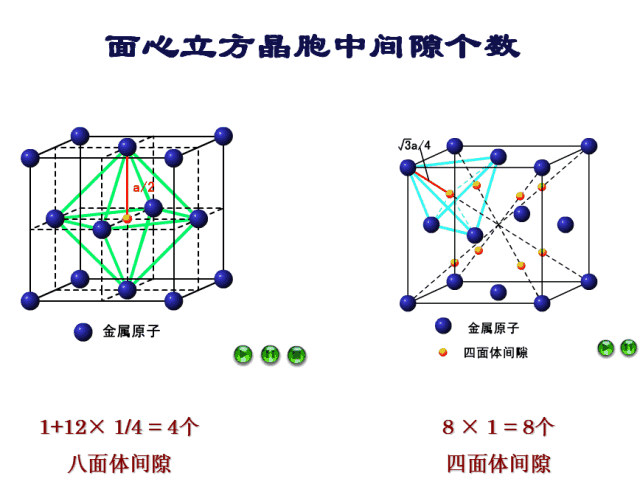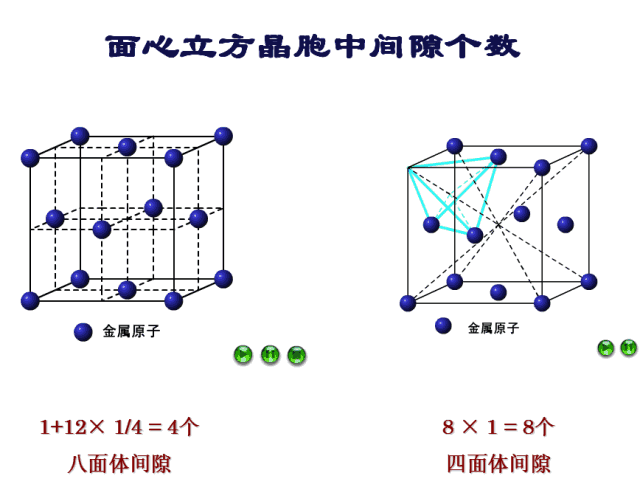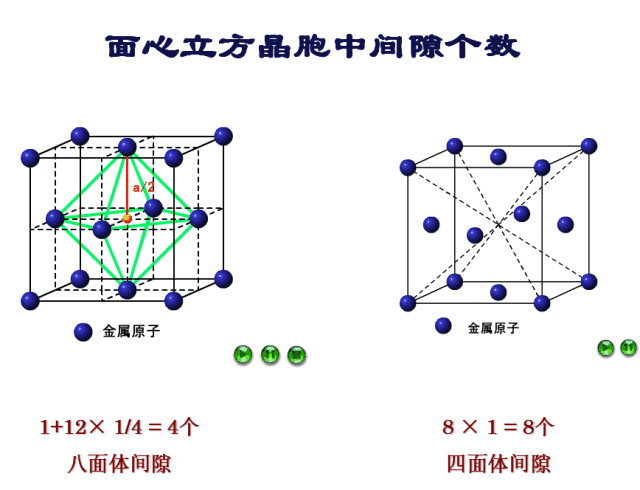
图12

- 全部评论(0)
