元素拓展:锰及其化合物总结
时间:2023-10-07 11:21 来源:未知 作者:化学自习室 点击: 次 所属专题: 锰及其化合物
版权申明:凡是署名为“化学自习室”,意味着未能联系到原作者,请原作者看到后与我联系(邮箱:79248376@qq.com)!
一、锰单质
块状锰是呈灰色,是一种较活泼的金属,在空气中金属锰的表面被一层褐色的氧化膜所覆盖,甚至与冷的浓硝酸也形成强的氧化膜,所以呈化学惰性。

二、锰的化合物的价态规律
稳定:Mn2+、MnO2(不溶于酸的固体)、MnO4-、Mn2O3(MnOOH(氢氧化氧锰))
不稳定:Mn3+、MnO42-(酸性条件下会歧化:3MnO42-+4H+=2MnO4-+MnO2+2H2O)
三、Mn(Ⅱ)
(1)溶解性:Mn(Ⅱ)强酸盐易溶,弱酸盐(MnCO3、硫化物),氧化物,氢氧化物为难溶(但可溶于稀酸)。
(2)[Mn(H2O)6]2+离子为苹果绿色
(3)还原性
①酸性介质中稳定,碱性介质中不稳定,易被氧化。在Mn2+盐溶液中加OH-,生成Mn(OH)2白色沉淀,而后在空气中迅速被氧化生成MnO(OH)2的棕褐色沉淀。
Mn2++ 2OH-=Mn(OH)2↓白色,
2Mn(OH)2+O2=2MnO(OH)2↓棕褐色
②酸性介质中,能被一些强氧化剂所氧化:
2Mn2++5S2O82-+8H2O=2MnO4-+10SO42-+16H+
2Mn2++5NaBiO3+14H+=2MnO4-+5Na++5Bi3++7H2O
2Mn2++5PbO2+4H+=2MnO4-+5Pb2++2H2O
其中Mn2+的鉴定常用NaBiO3为氧化剂在H2SO4或HNO3介质下反应。
③在浓硫酸中,MnSO4与KMnO4反应可生成深红色的Mn3+(实际是硫酸根的配合物):
MnO4-+4Mn2++8H+=5Mn3++4H2O
④在中性或近中性的溶液中,MnO4-与Mn2+反应生成MnO2:
2MnO4-+3Mn2++2H2O=5MnO2(s)+4H+
⑤Mn(OH)2易被氧化:
Mn2++2OH-=Mn(OH)2(s)(白色),
2Mn(OH)2+O2=2MnO(OH)2(s)(棕色)
(4)硫酸锰:
白色或微红色细小结晶体。无臭、味苦。加热到200℃以上开始失去结晶水,500℃左右变为无水物。易溶于水,不溶于醇。无机工业用于电解锰生产和制备各种锰盐。

(5)酸式磷酸锰:又称马日夫盐,分子式Mn(H2PO4)2,白色到灰白色或带微红色的结晶体。吸湿性较强。易溶于水并水解,水溶液呈酸性。不溶于醇。与氧化物接触极易引起变质。有腐蚀作用。常以水合物形式出现。水合物在100℃以上时脱水。主要用作钢铁防锈的磷化剂。

四、Mn(Ⅲ)
Mn3+可存在于浓硫酸中,若酸度降低,则Mn3+歧化为Mn2+和MnO2:
2Mn3++2H2O =Mn2++MnO2(s)+4H+
五、Mn(Ⅳ)
最重要的化合物是MnO2,是黑色结晶体或无定形粉末,在自然界中以软锰矿(MnO2·xH2O)形式存在。不溶于水和硝酸。在热浓硫酸中放出氧而生成硫酸亚锰。在盐酸中放出氯而生成氯化亚锰。与苛性碱和氧化剂共熔,放出二氧化碳而生成高锰酸盐。在535℃分解成三氧化二锰和氧。是强氧化剂。用作干电池去极剂,合成工业的催化剂和氧化剂,玻璃工业和搪瓷工业的着色剂、消色剂、脱铁剂等。

(1)强氧化性
在酸性介质中,MnO2是较强的氧化剂,本身被还原为Mn2+:
MnO2(s) + 4HCl(浓) MnCl2+Cl2↑+ 2H2O(实验室中制取氯气),
MnCl2+Cl2↑+ 2H2O(实验室中制取氯气),
2MnO2(s)+2H2SO4(浓)=2MnSO4+O2↑+2H2O,MnO2+2Fe2++4H+=2Fe3++Mn2++2H2O
(2)氧化H2O2:
MnO2+H2O2+2H+=Mn2++O2↑+2H2O
(3)碱熔条件下可被强氧化剂氧化为MnO42-(绿色):
2MnO2+4KOH + O2=2K2MnO4+2H2O,
3MnO2+6KOH + KClO3=3K2MnO4+KCl +3H2O,
MnO2+2MnO4-+ 4OH-=3MnO42-+ 2H2O
(4)锌锰干电池(Zn—MnO2—KOH),
正极:MnO2+e-+H2O=MnOOH+OH-
六、Mn(Ⅵ)
(1)存在形式:MnO42-绿色,最重要的化合物是:Na2MnO4和K2MnO4。
(2)在酸、中或弱碱条件下MnO42-均会发生歧化反应
MnO42-只在强碱性(pH>13.5)溶液中才能稳定存在,在中性或酸性介质中,MnO42-发生歧化反应:
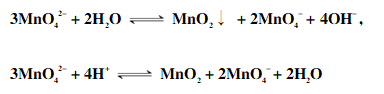
七、Mn(Ⅶ)
(1)主要形式:MnO4-—紫色;最重要的化合物是KMnO4。

(2)受热或光照会分解
2KMnO4=K2MnO4+MnO2+O2↑,
4MnO4+ 4H+=3O2↑ + 2H2O + 4MnO2
这是一个“自催化”反应,因此KMnO4应置于阴凉避光处保存,常用棕色瓶存放。
(3)强氧化性
①酸性介质:KMnO4氧化性很强,还原产物为Mn2+
2MnO4-+ 5SO32-+ 6H+=2Mn2++ 5SO42-+ 3H2O
MnO4-+ 5Fe2++ 8H+=Mn2++ 5Fe3++ 4H2O(用于定量测定铁含量)
2MnO4-+ 5H2C2O4+6H+=2Mn2++ 10CO2+8H2O(用于KMnO4浓度标定)
②中性、弱碱性介质还原产物为MnO2:
2MnO4-+ I-+ H2O =2MnO2+IO3-+ 2OH-
③碱性介质中,还原产物为MnO42-:
2MnO4-+ SO32-+ 2OH-=2MnO42-+ SO42-+ H2O
在强碱性溶液中,MnO4-能发生下列反应,生成浅蓝色的不稳定的MnO3-,并放出氧气:2MnO4-=2MnO3-+ O2,MnO3-进一步歧化反应:2MnO3-=MnO42-+ MnO2
④与浓H2SO4反应可生成Mn2O7
2KMnO4+2H2SO4(浓) =Mn2O7+2KHSO4+H2O
Mn2O7具有极强的氧化性,若受热会迅速分解产生爆炸,与有机物作用剧烈反应而着火,溶于CCl4中能较为稳定。
(4)用途
KMnO4是一优良的氧化剂,在分析化学中被用作氧化还原滴分析的氧化剂,还用于漂白棉、毛丝织品、油类的脱色剂,稀溶液被广泛用于医药卫生中的杀菌消毒剂。
(5)KMnO4的制备
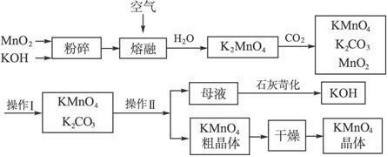


- 全部评论(0)
