加成反应是氧化还原反应吗?
时间:2025-09-28 10:08 来源:未知 作者:化学自习室 点击: 次 所属专题: 有机氧化还原反应 加成反应
版权申明:凡是署名为“化学自习室”,意味着未能联系到原作者,请原作者看到后与我联系(邮箱:79248376@qq.com)!
【导读】不一定。从氧化还原反应的外在特征:化合价升价看,加成反应中化合价不一定会发生变化,加成反应的本质是“不饱和键打开,原子或原子团直接结合”,化合价是否变化核心取决于反应物与加成试剂的成键类型(非极性键或极性键)以及产物中原子的成键电子对偏移是否改变。
若加成试剂为非极性试剂(如相同原子组成的分子、或自身聚合),产物中无新的极性键形成,电子对偏移不变,化合价不变(如烯烃聚合);
若加成试剂为极性试剂(如含不同电负性原子的分子,Br₂、H₂O、HCl等),产物中形成新的极性键,电子对偏移改变,化合价变化(如烯烃与溴、水的加成)。
一、非氧化还原的加成反应(非极性键加成)
当加成试剂由相同原子组成(成键为非极性键,电子对不偏移),且产物中原子的成键环境(与C、H等原子的连接方式)未改变电子对偏移时,化合价保持不变。有机反应中最典型的例子是烯烃的自身加聚反应。
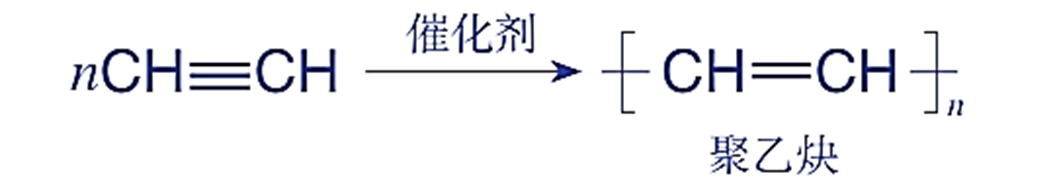
典例:CH₂=CH₂聚合生成聚乙烯
乙烯分子中的C=C打开,每个双键碳原子分别与另一个乙烯分子的双键碳原子形成C-C,最终连接成高分子链。整个加成过程中,C原子的化合价始终为-2价,H原子化合价始终为+1价,化合价未发生变化。
![]()
二、氧化还原的加成反应(极性键加成)
当加成试剂由不同原子组成(成键为极性键,电子对偏向电负性大的原子),且产物中不饱和碳原子与电负性不同的原子(如Br、O、Cl等)成键时,电子对偏移方向改变,导致化合价变化。这是有机加成反应中更常见的情况,典型试剂如Br₂、H₂O、HCl等。
典例:CH₂=CH₂与Br₂加成生成CH₂Br-CH₂Br
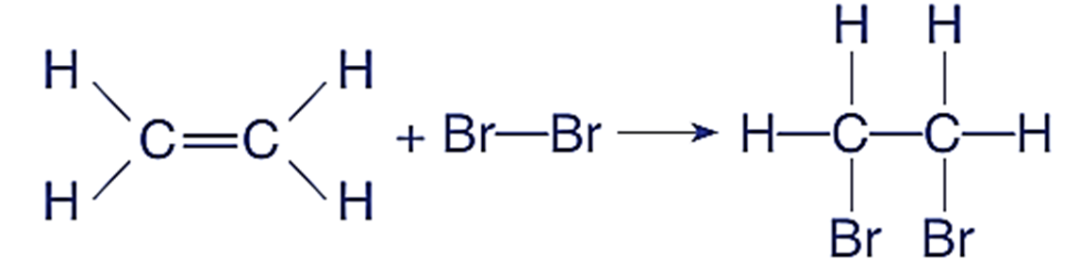
乙烯的碳碳双键打开,两个Br原子(来自Br₂的Br-Br为非极性键,但Br电负性远大于C)分别结合到两个双键C原子上,形成C-Br极性键。C原子化合价从-2价变为-1价,Br原子从0价变为-1价,化合价发生变化。
化合价简析:
反应物CH₂=CH₂中,C为-2价,Br₂中Br为0价(非极性键,电子对不偏移)。
产物CH₂Br-CH₂Br中,每个C原子与1个Br原子相连(Br电负性>C,电子对偏向Br,C为+1价/个Br)、2个H原子相连(C为-1价/个H)、1个C原子相连(C为0价)。因此,每个C的总化合价为:1×(+1)+2×(-1)+0=-1价。
三、非典例探讨
CH₂=CH₂+H₂O→C₂H₅OH
乙烯的碳碳双键打开,H(来自H₂O,H-O为极性键,H带部分正电)和-OH(带部分负电)分别结合到双键C原子上,形成C-H和C-O键。与-OH相连的C原子化合价从-2价变为-1价,从化合价发生变化的角度判定属于氧化还原反应。
![]()
化合价简析:
反应物乙烯中,C为-2价;H₂O中H为+1价,O为-2价。
产物乙醇中,与-OH相连的C原子:1个C-O键(O电负性>C,C为+1价)、2个C-H键(C为-1价/个H)、1个C-C键(C为0价),总化合价为:+1+2×(-1)+0=-1价;另一个C原子为-3价(仅与C、H相连)。

【异议】CH₂=CH₂与H₂O加成反应通常由酸催化,机理是H⁺(来自酸)先进攻双键,生成一个碳正离子,然后水分子(OH₂)再进攻碳正离子,最后失去一个H⁺得到乙醇。整个过程涉及的是质子(H⁺)的转移和亲核攻击,而非电子的完全转移。反应的本质是水分子(H-OH)作为一种试剂,其H⁺和OH⁻部分分别加到两个碳上,水本身既不是氧化剂也不是还原剂。
换个角度看这个反应在性质上更类似于中和反应或水解反应,而不是像氢气(H₂)加成那样的还原反应。
总结:


- 全部评论(0)
