怎样复习化学平衡
时间:2016-02-01 13:48 来源: 作者:爱莉 点击: 次 所属专题: 化学平衡
版权申明:凡是署名为“化学自习室”,意味着未能联系到原作者,请原作者看到后与我联系(邮箱:79248376@qq.com)!
化学平衡理论,既是化工生产的理论,又是指导电解质溶液理论学习的理论,由于这部分知识的理论性较强,有关的规律多,还有许多图象问题,掌握起来不太容易。下面谈谈怎样进行这部分知识的复习。
1.掌握基本概念,善于总结规律
复习中要掌握基础知识和学会应用,前者指正确理解重要的基本概念和熟悉各种规律,建立起比较完整的知识结构;后者指会利用所学的知识和规律去正确解题。所建的知识结构越完整,解决问题的能力就越强。在这部分知识中,基本概念有:化学反应速率、化学平衡状态、化学平衡移动、有效碰撞、活化分子、反应物的转化率和可逆反应,其中,以前三个概念最为重要。对于重要的基本概念,要很深刻地理解其定义。怎样才能理解和掌握好定义呢?要抓住定义中的条件和结论,弄清概念的内涵和外延。例如,对于化学平衡状态的定义,(1) 要知道平衡是一种状态,状态是不随时间改变的;(2) 要理解“一定条件”的涵义,对于不同的反应,这一定的条件是不同的;(3) 必须是可逆反应,化学平衡是可逆反应的一种特殊状态;(4) 正、逆反应速率相等和各组分的浓度不变是判断平衡状态的两个标准,前者从微观上反映,后者从宏观上表现。另外,要理解化学平衡的特点:动、定、变。可逆反应一当处于化学平衡状态,则一切宏观量皆保持不变,从而可得出一等六定:正、逆反应速率相等,平衡混合物中各物质的物质的量不变,平衡浓度不变,反应物的转化率不变,生成物的产率不变,正、逆反应速率不变。除此之外,对于反应前后气体体积不相等的可逆反应,也可以通过压强、气体密度和气体平均分子量等保持一定来判断平衡状态。
又如,化学平衡的移动,要从下列几个方面去理解:(1) 必须是一个可逆反应,这是讨论平衡移动的前题;(2) 移动是一个过程,过程与时间有关,必有始态和末态,即有一个旧平衡和一个新平衡;(3) 外部条件(浓度、压强和温度)必然发生改变,这是平衡发生移动的因素;(4) 平衡移动的结果是浓度要发生变化。要弄清楚什么是平衡向右移动和向左移动,以及判断平衡移动方向的准则;要从实质上去认识,只有正、逆反应速率相等关系被打破时平衡才会被破坏,从而发生移动;而平衡发生移动,则平衡体系中各物质的百分含量一定要改变。因此,反应速率、平衡浓度改变了,平衡不一定发生移动;而百分含量改变了,平衡一定发生移动。结合条件对平衡的影响以得出,改变温度,或改变平衡体系中任一物质 (固体和纯液体例外) 的浓度,平衡一定会发生移动,使用催化剂则不影响平衡,改变压强或容器的体积不一定使平衡发生移动。
在复习中,可以通过比较来理解重要的概念,如许多学生往往把反应速率和化学平衡搅在一起,纯速率的问题总要从平衡角度去考虑。因此,在复习中有必要弄清二者的区别和联系(参看下表)。
| 反 应 速 率 | 化 学 平 衡 | |
问 题 范 围 影响因素 时 间 | 反应快慢——生产周期(时间) 可逆反应和不可逆反应 内因一一性质(起决定作用) 外因一一条件( C、P、T 和催化剂等)
| 反应程度——产率 可逆反应 外因一—条件( C、P、T )(起决定作用) 平衡状态≠¦(t) | |
联 系 | (1) 反应速率大小与建立平衡状态时间的关系 反应速率快 达到平衡的时间短 反应速率慢 达到平衡的时间长 (2) 正、逆反应速率与建立平衡状态的关系 (3) 正、逆反应速率与平衡移动的关系 (4) 平衡时,随时间推移 正、逆反应仍在进行 平衡状态不变 | ||
|
|
|
|
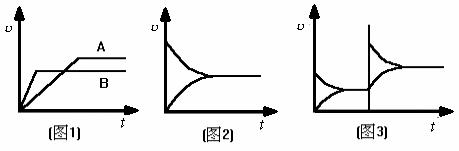
在上述对比中,还可以将有关图象结合起来。由联系 (1) 可以得出图1 ,并可知![]() A<
A<![]() B;由联系 (2) 可得出图2 ,并可知条件不变,即得到一条平衡于时间轴的直线;由联系 (3) 可得出图3,并可知强者决定平衡移动的方向,即图中上方速率决定平衡移动的方向。
B;由联系 (2) 可得出图2 ,并可知条件不变,即得到一条平衡于时间轴的直线;由联系 (3) 可得出图3,并可知强者决定平衡移动的方向,即图中上方速率决定平衡移动的方向。
又如,对气体反应来说,浓度和压强的影响是相同的,改变压强对反应速率的影响,实质上是浓度变化的影响;但二者又有区别,压强只对气体反应有影响,而浓度则对气体反应和溶液反应皆有影响;改变压强是对整个平衡体系而言,而浓度的改变可以是任意反应物或生成物。因此,在解释压强对化学平衡的影响时,要从浓度的变化去考虑;而在气体可逆反应中,若同时增大体积或缩小体积,即反应物和生成物浓度同倍改变时,无法判断平衡移动方向,此时应将浓度问题转化为压强问题考虑,才能判断平衡移动的方向。另外,对于加入惰性气体于定容或定压的密闭容器,平衡是否移动的问题,也要用这个规律去解决。加入惰性气体能否影响平衡,关键在于浓度是否改变。若定压时,由于容器体积增大,浓度减小,对于反应前后气体分子数不等的反应,平衡要发生移动;若定容,尽管压强增大,因为浓度未发生变化,平衡不发生移动。
抓小规律是化学学习的一大特点,要在抓着两个条件影响的大规律的同时,总结和掌握各种小规律,特别是在解题过程中去总结各种小的规律。例如,温度改变对反应速率的影响是吸热反应大于放热反应;压强改变对气体反应速率的影响是气体体积减小的方向大于气体体积增大的方向;正反应速率随反应物浓度变化,逆反应速率随生成物浓度变化;反应物和生成物的变化量绐终是系数比的关系,等等。
在理解有关的规律中,要注意粗略的数量关系,例如,通过反应条件对化学反应速率影响的分析要得出这样的粗略数量关系,即增加气体或溶液的浓度,可以加快反应速率;增大气体反应物的压强,实质上是增大了气体的浓度,也可以加快反应速率;升高温度成倍地加快反应速率;使用正催化剂成千千上万万倍地加快反应速率。并能自觉地利用条件对反应速率影响的主次关系,去解决有关问题。
2.熟悉各种题型,掌握解法技巧
熟悉各种题目类型和掌握尽可能多的解题方法会增强自信心,提高应试能力,使你在考试时能轻松自如,缓解紧张情绪。掌握了有关的解题思路,就不至于在陌生的问题前惊慌失措。常说的题型有基本题型和特殊题型,有传统题型和新题型。如反应速率的基本题型有计算反应速率和条件对反应速率的影响,而通过反应速率计算时间,同一反应中用不同反应物表示的反应速率大小的比较则是两类特殊的新题型。化学平衡的一般题型有:平衡状态的判断,平衡移动,有关平衡的一般计算,以及图象题。而有关同一平衡状态的计算,连续平衡的计算,以及确定平衡方程式的系数等则属于特殊的新题型。解题方法有一般解法和特殊解法,有常规解法和技巧解法。要建立解题的基本模式,如求反应速率和有关化学平衡的计算等,能列出有关物质的三种量:初始量、变化量和剩余量或平衡量,一般都能解出。有些问题有公式计算,如求反应速率和求反应物的转化率有定义公式,根据两种反应速率和某温度时的完成时间求另一温度时的完成时间,只有一种反应物的分解率的计算,建立相同平衡状态的计算,都有相关的公式或关系式。另外,计算中还要用到质量守恒定律,气体的平均分子量,气体压强与物质的量成正比,气体体积与物质的量成正比等相关知识;还会用到差量关系或求和公式变式( 包括十字交叉法和三角正弦法 )进行技巧运算。
例如,在容积可变的密闭容器中,充入适量A和B的混合气,一定条件下发生反应:A(g)+3B(g) 2C(g),若维持温度与压强不变,达平衡时,容器容积为V L,其中C占10%,下列推断中正确的是 ( )
2C(g),若维持温度与压强不变,达平衡时,容器容积为V L,其中C占10%,下列推断中正确的是 ( )
A. 原A、B混合气体积为1.2V L
B. 原A、B混合气体积为1.1V L
C. 达平衡时消耗A 体积为0.05V L
D. 达平衡时消耗B体积为0.05V L
只要能列出如下计算模式:
A(g) + 3B(g)  2C(g)
2C(g)
V0 (L) 0.11V 0
V变(L) 0.05V 0.15V 0.1V
V平(L) 0.90V 0.1V
就不难得出正确结果:BC。
又如:将对H2相对密度为3.6 的N2与H2组成的混合气0.5 mol 通入一恒容密闭容器中,一定条件下发生反应,平衡时容器内压强比反应前少了24%。求:
(1) 反应前混合气中N2和H2的质量比。
(2) 平衡混合气中,含氨的体积分数。
(3) 平衡时N2、H2的转化率。
这种题首先要利用相对密度求出混合气的平均相对分子量为 7.2,利用十字交叉法求出N2、H2的物质的量比为1∶4,从而得出N2、H2的质量比为 7∶2。然后设未知数列出下列平衡计算模式:
N2(g) + 3H2(g)  2NH3(g)
2NH3(g)
n 0(mol) 0.4 + 0.1 + 0 = 0.5
n变(mol) 3x x 2x
n平(mol) 0.4-3x + 0.1-x + 2x = 0.5-2x
根据压强与物质的量成正比,可得出2x = 0.12 mol,即可求出NH3的体积分数为31.6%。最后可求出N2、H2的转化率分别为60%和40%。
总之,要通过多题一解总结出解题的思路和方法;要通过一题多解去寻求思维的发散,找寻不同的解题方法和技巧,并比较各种解法的优劣,以得到最佳的解法;要通过题目的变式练习,以求得解题方法的灵活多变,增强应变能力。
3.加强解题训练,注意能力提高
复习中,搞题海战术、盲目做题是不行的,但没有一定题量的训练也不可能掌握所学的知识。问题是要通过做题,一是检查知识的掌握情况,查缺补漏;二是训练思维的灵活性,通过定时训练提高解题速度;三是对同种类型的题要模索出一些规律,公式和解法;四是通过做题,发现解题过程中出现的毛病,如书写不规范,审题不清,粗枝大叶,计算错误等,以便纠正错误习惯,减少过失性失分。
在解答本章的问题时,特别要认真读题,弄清题意,注意题目中的条件和提法,是反应速率问题还是化学平衡问题?反应体系处在什么状态?什么条件一定?改变的条件是什么?是同等程度改变还是不等量改变;是只改变反应物或生成物的量,还是所有物质的量都改变了?气体反应都是在密闭容器中进行的,这容器是一般密闭的容器,还是固定体积的密闭容器?是定容还是定压?对于图象问题,要把坐标轴所代表的物理量搞清楚,各物理量的单位是什么,还要弄清纵坐标表示的是反应物,还是生成物,坐标轴的刻度大小,坐标原点是否为0;弄清图中曲线的形状和涵义,是直线、弧线还是曲线,看看曲线的起点和终点,有无特殊点( 拐点 )。对于陌生的信息更要认真分析,它反应的规律是什么?该信息与其它已知条件的关系,在解题中起什么作用?总之,只有很好地理解了题意,才能正确解题。只有这样才能训练出正确的解题思路,获得各类题型的解题方法和技巧,提高分析问题和解决问题的能力。

- 全部评论(0)
