元素倒置之谜
时间:2007-09-10 12:22 来源: 作者:刘柳 点击: 次 所属专题: 原子序数
版权申明:凡是署名为“化学自习室”,意味着未能联系到原作者,请原作者看到后与我联系(邮箱:79248376@qq.com)!
元素倒置之谜
——揭示元素周期律的本质
门捷列夫是按照元素的原子量大小排成元素周期表的。可是门捷列夫对周期表中Co—Ni、Te—I等元素的原子量的顺序和它们在表中位置的颠倒却无法理解。
Co的原子量大于Ni的原子量,Te的原子量大于I的原子量,可是按照它们化学性质的周期性,又必须将Co排在Ni的前面,将Te排在I的前面。门捷列夫一直怀疑它们的原子量测定有错误。
后来,人们发现了惰性气体,又出现了K—Ar的倒置。18号元素氩的原子量为39.94,而19号元素钾的原子量只有39.098。
这些轻重倒置的不合理现象,困惑了科学家们达几十年之久。解开周期表中“倒置之谜”的是英国年轻的科学家莫斯莱。
莫斯莱大学毕业后,来到卢瑟福的实验室工作,很快就显示出他杰出的才华。卢瑟福十分器重他,同事们也议论他有可能成为“第二个卢瑟福”。
莫斯莱以X射线为工具去探索原子量世界内部的奥秘。在X射线管中,当电子的速度一定时,电子流打在不同材料制成的阴极上,放出的X射线的波长也不同。
为了搞清原子序数和原子结构的关系,1912年,莫斯莱给自己提出一项任务:要求系统地研究从各种化学元素制成的阴极所得X射线的波长。他的实验工作是艰苦而紧张的,他先将不同的金属制成阴极,不厌其烦地一个接一个地测量了许多金属阴极发出的X射线的波长,从而取得了大量的数据。
从这些数据中他总结出一个规律:绝大多数情况下,原子量越大的金属,它们所发射的X射线的波长越短。
Ni的波长小于Co的波长,这和它们的原子量的大小顺序不符,却和周期表的排列次序相一致。这种规则的出现意味着什么呢?莫斯莱深人地思考起来。
莫斯莱把实验数据重新加以整理,并绘成图表,在整理实验结果时,他终于领悟了隐藏在数据中的一个有趣的规律:不同元素发射出来的X射线的波长的倒数(即X射线的频率)的平方根,和该元素的原子序数成正比例关系。
莫斯莱还想到,随着原子量的增加,原子核所带的正电荷也相应增加。
经过进一步分析,他还发现元素的原子核所带的正电荷数目,正好是它们在周期表上的位置(即原子序数)。
Ni的波长小于Co的波长,正说明Ni原子核所带的核电荷数大于Co的核电荷数。这和周期律的排列是相吻合的。
K和Ar、 I和 Te的倒置矛盾也得到了合理的解释,元素倒置之谜从此烟消云散了。
莫斯莱的这一研究成果表明:化学元素的性质不是和原子量直接相关的,而是和原子序数相关,和原子核所带的核电荷数相关。从而揭开了元素周期表的本质。
随着科学的进步,后来科学家们又发现,化学元素的原子序数在数值上就等于该元素原子核中的质子数。化学元素的性质又和它们的原子结构存在着内在的必然联系,这种关系就表现在元素在周期表中的位置上,因而形成了以下的一个三角公式:
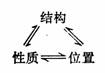
元素的原子结构决定元素的性质,而性质是结构的反映。
莫斯莱的科学贡献是巨大的,但他的生命和事业却是极为短促的。 在第一次世界大战中,他在英国军队中担任信号员。1915年8月10日,一颗土耳其人的子弹击穿了他的头颅,这位年青的科学家顿时身亡。当时,莫斯莱年仅28岁,他的早逝是科学界的损失。
(责任编辑:化学自习室)

说点什么吧
- 全部评论(0)
还没有评论,快来抢沙发吧!
