高考电解题型及应对策略
时间:2014-12-18 11:14 来源: 作者:吴键 点击: 次 所属专题: 电解池
版权申明:凡是署名为“化学自习室”,意味着未能联系到原作者,请原作者看到后与我联系(邮箱:79248376@qq.com)!
一. 考查电解原理
例1. 镍氢电池是近年来开发出来的可充电电池,它可取代会产生镉污染的镍镉电池。镍氢电池的总反应式是
根据此反应式判断,下列叙述正确的是( )
A. 电池放电时,电池负极周围溶液的pH不断增大
B. 电池放电时,镍元素被氧化
C. 电池充电时,氢元素被还原
D. 电池放电时,H2是负极
解析:放电时,H2作原电池负极被氧化,其电极周围溶液的pH应不断减小,而NiO(OH)被还原。充电时Ni(OH)2被还原成H2,所以选C、D项。
点评:充电电池,放电时以原电池原理工作,负极发生失电子的氧化反应,正极发生得电子的还原反应。充电时以电解池原理工作,阳极发生失电子的氧化反应,阴极发生得电子的还原反应。
二. 考查电解规律
例2. 在电解水制取H2和O2时,为了增强导电性,常常要加入一些电解质,最好选用下列物质中的( )
A. NaOH B. HCl C. NaCl D. CuSO4
解析:若加入HCl、NaCl,阳极应优先放出Cl2;若加入CuSO4,阴极将优先析出Cu,所以选A项。
点评:以惰性电极电解电解质溶液前后溶液pH的变化规律:有氢无氧增碱性,有氧无氢增酸性,有氢有氧增原性,无氢无氧减原性。
三. 根据电极变化判断金属活动性强弱
例3. X、Y、Z、M代表四种金属元素,金属X和Z用导线连接放入稀H2SO4中时,X溶解,Z极上有氢气放出;若电解Y2+和Z2+共存的溶液时,Y先析出;又知M2+的氧化性强于Y2+,则这四种金属的活动性由强到弱的顺序是( )
A. X>Z>Y>M B. X>Y>Z>M C. M>Z>X>Y D. X>Z>M>Y
解析:金属X和Z用导线连接放入稀H2SO4中形成原电池,X溶解说明X的金属活动性大于Z,电解Y2+和Z2+共存的溶液时,Y先析出,则Z的金属活动性大于Y,M2+的氧化性强于Y2+,则Y的金属活动性大于M。故选A项。
四. 考查电解原理在实验创新和工农业生产上的应用
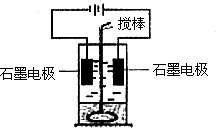
例4. 在玻璃圆筒中盛有两种无色的互不相溶的中性液体。上层液体中插入两根石墨电极,圆筒内还放有一根下端弯成环状的玻璃搅棒,可以上下搅动液体,装置如图。接通电源,阳极周围的液体呈现棕色,且颜色由浅变深,阴极上有气泡生成。停止通电,取出电极,用搅棒上下剧烈搅动。静置后液体又分成两层,下层液体呈紫红色,上层液体几乎无色。根据上述实验回答:
(1)阳极上的电板反应式为_______________。
(2)阴极上的电极反应式为_______________。
(3)原上层液体是___________________。
(4)原下层液体是___________________。
(5)搅拌后两层液体颜色发生变化的原因是___________________。
(6)要检验上层液体中含有的金属离子,其方法是___________,现象是__________。
解析:根据溶液的分层现象及上层溶液可以电解、阳极周围溶液颜色的变化和静置后下层液体呈紫红色可以推断电解质溶液为碘盐溶液,阳极电极反应式为 ![]() ,阴极电极反应式为
,阴极电极反应式为 ![]() ,又由于溶液为中性,所以原上层液为KI(或NaI)水溶液,可通过焰色反应检验其中的金属离子,下层液为CCl4(或CHCl3等),由于I2在CCl4中的溶解度远大于在水中的溶解度,所以I2被萃取到CCl4中。
,又由于溶液为中性,所以原上层液为KI(或NaI)水溶液,可通过焰色反应检验其中的金属离子,下层液为CCl4(或CHCl3等),由于I2在CCl4中的溶解度远大于在水中的溶解度,所以I2被萃取到CCl4中。
五. 考查有关电解产物的判断和计算
例5. 通过相等的电量,以石墨为电极分别电解等浓度的硝酸银和硝酸亚汞(亚汞化合价为+1)溶液,若被还原的硝酸银和硝酸亚汞的物质的量之比为 ![]() ,则下列表述正确的是( )
,则下列表述正确的是( )
B. 在两个阳极上得到的产物的物质的量不相等
C. 硝酸亚汞的化学式为HgNO3
D. 硝酸亚汞的化学式为Hg2(NO3)2
解析:因为通过相等电量,且银和亚汞的化合价都是+1,所以得到的银和汞物质的量相等,阳极所得产物物质的量也相等,而被还原的![]() ,硝酸银的化学式为AgNO3,所以硝酸亚汞的化学式为Hg2(NO3)2。故选D项。
,硝酸银的化学式为AgNO3,所以硝酸亚汞的化学式为Hg2(NO3)2。故选D项。
点评:有关电解的计算通常有两种解题方法:一是根据电解方程式或电极反应式列比例式求解;二是利用各电极、线路中转移的电子数目守恒或溶液中粒子电荷守恒列式求解。
六. 考查与物理学的综合
例6. 由实验得知,用电解法将电解液中的金属阳离子还原为金属单质时,电极上所通过的电量Q正比于金属物质的量n和金属离子电荷数a的乘积,其比例系数F是一个恒量,称为法拉第常数,它与金属的种类无关。(已知阿伏加德罗常数 ![]() ,电子电量为
,电子电量为 ![]() ,
,![]() )
)
(1)试求出法拉第常数。
(2)如果电解CuSO4溶液获得1kg的金属铜,求通过电解槽的电量。
等。离子方程式、化学方程式、电极反应式、用电子式表示物质形成过程等化学用语易混易错,复习时要将这类概念列表比较,建议在理解含义的基础上背会定义。
关键点拨 根据题意,原子经济性最好的反应,是产物只有一种。化合反应、加成反应、加聚反应、分子重排反应等都是原子经济性最好的反应。如果原子经济性不为100%,则副产物越少越好。
(3)用电镀法在半径为R的铜壳表面均匀镀上很薄的银层,在电解槽中铜球是阳极还是阴极?另一电极是什么材料?若电流强度为I,通电时间为t,银的摩尔质量为M,银的密度为d,求镀层的厚度h(用本题中的符号表示)。
解析:根据题给信息可知:Q=Fna,得 ![]() 。利用(1)中表达式可得出(2)中通过电解槽的电量为
。利用(1)中表达式可得出(2)中通过电解槽的电量为
(3)中在铜球表面镀银,铜球为阴极,阳极材料为银。镀上银的物质的量
因为镀层很薄,所以
点评:由于电解常涉及物理学中的电学知识,所以关于电解的知识必然会成为物理学与化学的交汇点,常利用电量、电流强度、通电时间等物理量进行联系,这正反映了理科综合的测试精神,所以关于电解的这类知识会成为理科综合的热点。

- 全部评论(0)