浅议物质溶解过程的能量变化
时间:2016-03-10 18:20 来源:未知 作者:玉素甫 点击:次 所属专题: 物质溶解过程
版权申明:凡是署名为“化学自习室”,意味着未能联系到原作者,请原作者看到后与我联系(邮箱:79248376@qq.com)!
初中化学课本中解释溶解过程的热效应时写道:“怎样解释物质溶解时,有的吸热,而有的放热呢?这是因为,物质溶解在水里,通常发生两种过程:一种是溶质 的分子(或离子)的扩散过程,这种过程吸收热量,是物理过程;另一种是溶质的分子 (或离子 ) 和水分子作用,形成水合分子(或水合离子〉的过程,这种过程放出热量, 是化学过程。物质溶解的时候,溶液的温度是升高还是降低,要看在这两种过程里,是放出的热量多于吸收的热量,还是吸收的热量多于放出的热量而定。”(以下简称“课 本”)
我认为“课本”的这段叙述不甚妥当,现提出来与同行们商讨。
物质溶解时,溶质的分子或离子要克服彼此间引力,脱离离子或分子晶格,然后扩散到洛剂中去,“课本”中仅以扩散过程来代替是不全面的;物质溶解时,溶质的分子或 离子要彼此分离,溶剂的分予也要分离,留出容纳溶质分子或离子的空穴,这都要吸收 热量,“课本”中仅以溶质微粒扩散过程所需热量来代替,也是欠妥的。
初中物理课本第二册在讲分子运动时写道:“不同的物质在互相接触时, 彼此进入对方的现象叫扩散。”,物理扩散过程是自由能减小的自发过程,其热效应数值 一般较小,而克服溶质微粒间引力所需能量数值一般较大,如离子晶体的晶格能数值一 般为数百千焦•每摩尔,两者相益甚大。, '
以离子晶体碱金属卤化物为例,其溶解过程能量变化可用下列循环表示:
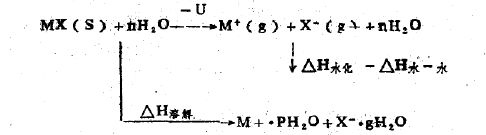
U表示离子晶体的晶格能,是指自由的气态正、负离子形成1摩尔离子晶体所放出 的能量,碱金属卤化物的晶格能一般为数百至一千多千焦•每摩尔。
△H水化表示晶体盐的水化热,P、Q分别是正、负离子的水化数,水化热是指1摩尔气态正负离子和1摩尔气态负离子分别与水作用所放出的热量之和,数值一般亦为数百至一千多千焦•每摩尔,△H水-水表示水分子克服彼此静电引力(特别是氢键〉形成容纳溶质分子或离子的空穴所需能量,这与溶质的性质及跟水结合的数量和方式有关,据推测,此值约为100—300千焦•每摩尔,有关书籍中将这两项并成一项,称为水合热,那么,所列数据实际上为晶体盐水合热克服△H水-水后净放出的热量。
△H溶解为晶体盐的溶解热,这里指的是1摩尔该物质溶于水形成无限稀释溶液的热效应。
据上述循环,可得:
△H溶解=△H水化一U一△H 水一水
由此可见,晶体盐溶解时,破坏晶格需要收吸热量,使溶剂分子彼此分离也要吸收热量,离子水化则放出热量。溶解热就是这两种热量之差。当水化热大于晶格能及 △H水-水之和时,溶解放热,溶液温度升离; 反之吸热,溶液溫度降低。
碱金属卤化物晶体的晶格能U与△H水-水之和与水化热值旗鼓相当,故溶解热一 般都是不大的正值或负值。当水化作用强烈而晶格能相对小者,放热显著,如NaOH; 反之,吸热显著,如NH4NO3
液体物质,如浓H2SO4溶于水放出大量热,是由于H+离子与SO42-离子分别与水作用放出热量较大,而消耗于克服H2SO4分子间缔合及H+离子与SO42-离子间引力热量较少之故。这一解释,同样也适用于其它电解质在水中的溶解。
同样,非电解质如蔗糖溶解于水,克服其分子间引力及水分子间引力要吸收热,它们与水分子发生水合作用则放出一定热量。溶解热也是这两种热量之差。
溶解热与溶质、溶剂的性质,温度、浓度等因素有关,各种物质的结构不同因而它们溶解时所产生的热效应不一样。
因此,溶解过程的热效应应这样解释,
物质的溶解过程就是溶质的分子或离子在溶剂分子(如水分子)的作用下,克服彼此引力并向溶剂中扩散的过程。溶质在溶解时,溶质的分子或离子要彼此分离,溶剂的分子也要彼此分离,这都要吸收热量溶质的分子或离子与溶剂分子相互作用,生成溶剂化分子(如水合分子)或离子(如水合离子)放出热量。溶解热就是这两种热量之差,溶解热如果是负值,溶解时放热,溶液温度升高;溶解热如果是正值,溶解时吸 热,溶液温度降低。

- 全部评论(0)
