纯硫酸等共价化合物的导电原因
时间:2021-11-29 19:34 来源:未知 作者:关平 点击:次 所属专题: 硫酸 自耦电离 共价化合物
版权申明:凡是署名为“化学自习室”,意味着未能联系到原作者,请原作者看到后与我联系(邮箱:79248376@qq.com)!
一、问题的提出
由于离子化合物如氯化钠其自身就含有离子,不论在熔融状态还是在水溶液中都能产生自由移动的离子,这些自由离子在外加电场的作用下能定向移动,因而能导电。液态氯化氢由于自身没有离子的存在故不能导电,只有在水溶液中才能产生自由离子而导电。因此人们常误认为共价化合物其液态一定不能导电。更有甚者,在化学教学的习题分析时一提到不导电的化合物就立马指出:液态共价化合物都不能导电,一定要把纯硫酸、纯硝酸连同液态氯化氢一起排除掉!并反复强调这是“题眼”。然而,所有纯液态共价化合物都一定不能导电吗?或者说能导电的液态化合物一定不是共价化合物吗?
二、问题分析
1.纯硫酸导电的原因
大家知道,纯H2SO4是无色液体,它是从98%的商品酸首先补加SO3或发烟硫酸,然后用水滴定到正确的比电导或熔点而制得。尽管H2SO4是共价型分子,在其纯晶态中,具有S-O之间的距离为0.142、0.143、0.1 52和0.155nm的
SO4四面体,它们以强的氢键相连接。但液态纯H2SO4却表现出强烈的自电离作用,结果产生很高的电导性,即纯H2SO4是具有较强导电性能的。原因可用下列平衡式表示:
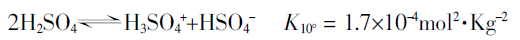
上式只是一个因素,由于脱水作用,因而还有几个附加的平衡存在:
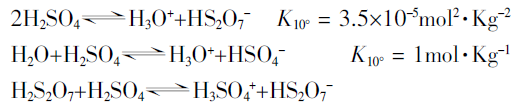
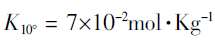
从而能估算出在100%H2SO4中存在的其它组分H3O+、HsO4-、H3SO4+、HS2O7-和H2S2O7的浓度。有报道,在 25℃时,HSO4-为0.023mol·L-1。因此,液态纯硫酸能导电,反复实验中也能明显观察到这种实验现象。
2.纯硝酸导电的原因
纯硝酸是无色液体或白色晶态固体。在0℃时用100%H2SO4处理KNO3,用真空蒸馏法抽走HNO3能制得纯硝酸。
HNO3是共价化合物,但实验中也能观察到纯硝酸的导电现象。这是什么原因呢?
事实上,纯硝酸是液体纯酸中自电离最高的酸,其起始质子迁移作用为:
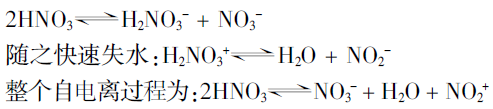
由于强烈自电离的存在,纯硝酸能导电是勿容置疑的。
3.纯五卤化磷导电的原因
PCl5是一种白色固体,加热到160℃不经过液态阶段就变成蒸气。虽然PCl5也是一种共价化合物,但在加压下于148℃液化,可形成一种能导电的熔体。那么如何理解和解释这种现象呢?
实际上,人们进一步测得这种熔体存在两种P-Cl键长,它们分别为198pm和206pm。于是可推断该熔体中存在下列平衡:
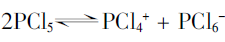
PBr5气态分子结构与PCl5相似,它的熔体也能导电,但经测定其中只存在一种P-Br键长。为什么PBr5熔体也能导电呢?
由实验事实可推断PbR5熔体存在的平衡如下:
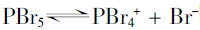
没有PBr6-离子的存在,可能是Br-离子半径太大,P原子周围容纳不了6个Br原子的原因。
4.纯卤氟化物导电的原因
某些卤氟化物,特别是ClF、BrF3和IF5,具有高的气化熵,这反映出它们在液态存在某种缔合。
BrF3和IF5也呈现有明显的导电性。其自电离过程为:
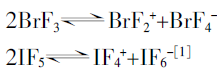
三、结论
通过上述分析不难看出,尽管纯硫酸、纯硝酸及五氯化磷等化合物都属于共价化合物,但由于它们都存在强烈的自电离作用,使其液态都存在较高浓度的自由离子因而具有导电性能。因此,将所有纯液态共价化合物一概排除在能导电的化合物之外是欠妥的。

- 全部评论(0)
