电化学中的“离子交换膜”
时间:2022-11-16 15:29 来源:未知 作者:化学自习室 点击:次 所属专题: 离子交换膜
版权申明:凡是署名为“化学自习室”,意味着未能联系到原作者,请原作者看到后与我联系(邮箱:79248376@qq.com)!
离子交换膜是一种含有离子基团的、对溶液中的离子具有选择透过能力的高分子膜,也称为离子选择透过性膜。
1.离子交换膜的功能
使离子选择性定向迁移(目的是平衡整个溶液的离子浓度或电荷)。
2.离子交换膜在电化学中的作用
(1)隔离某些物质防止发生反应。
(2)用于物质的制备。
(3)物质分离、提纯等。
3.离子交换膜的种类
根据透过的微粒,离子交换膜可以分为多种,在高考试题中主要出现阳离子交换膜、阴离子交换膜和质子交换膜三种。阳离子交换膜只允许阳离子通过,阻止阴离子和气体通过,阴离子交换膜只允许阴离子通过,质子交换膜只允许质子(H+)通过。可见离子交换膜的功能在于选择性地通过某些离子和阻止某些离子来隔离某些物质。
一、提高电流效率
交换膜隔离两种电解质溶液,避免负极材料与能发生反应的电解质溶液直接接触,能提高电流效率。在这种装置中,交换膜起到盐桥作用,且优于盐桥(盐桥需要定时替换或再生)。通过限制离子迁移,使指定离子在溶液中定向移动形成闭合回路,完成氧化剂和还原剂在不接触条件下发生氧化还原反应。
典例1 已知:电流效率=电路中通过的电子数与消耗负极失去电子总数之比。现有两个电池Ⅰ、Ⅱ,装置如图所示。
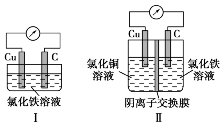
下列说法正确的是( )
A.Ⅰ和Ⅱ的电池反应不相同
B.能量转化形式不同
C.Ⅰ的电流效率低于Ⅱ的电流效率
D.5 min后,Ⅰ、Ⅱ中都只含1种溶质
答案:C
解析:Ⅰ、Ⅱ装置中电极材料相同,电解质溶液部分相同,电池反应,负极反应为Cu-2e-===Cu2+和正极反应式为Fe3++2e-===Fe3+分别相同,A项错误。Ⅰ和Ⅱ装置的能量转化形式都是化学能转化成电能,B项错误。Ⅰ装置中铜与氯化铁直接接触,会在铜极表面发生反应,导致部分能量损失(或部分电子没有通过电路),导致电流效率降低。而Ⅱ装置采用阴离子交换膜,铜与氯化铜接触,不会发生副反应,放电过程中交换膜左侧负极的电极反应式为Cu-2e-===Cu2+,阳离子增多;右侧正极的电极反应式为2Fe3++2e-===2Fe2+,负电荷过剩。Cl-从交换膜右侧向左侧迁移,电流效率高于Ⅰ装置,C正确。放电一段时间后,Ⅰ装置中生成氯化铜和氯化亚铁,Ⅱ装置中交换膜左侧生成氯化铜,右侧生成了氯化亚铁,可能含氯化铁,D项错误。
二、限制离子迁移
反应物相同,不同的交换膜,迁移的离子种类不同;同种交换膜,转移相同的电子数,如果离子所带电荷数不同,迁移离子数不同。离子迁移依据电荷平衡,而离子数目变化量可能不相等。
典例2 某原电池装置如图所示,电池总反应为2Ag+Cl2===2AgCl。
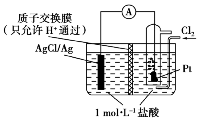
(1)当电路中转移a mol e-时,交换膜左侧溶液中约减少________mol 离子。交换膜右侧溶液中c(HCl)________ (填“>”“<”或“=”)1 mol·L-1(忽略溶液体积变化)。
(2)若质子交换膜换成阴离子交换膜,其他不变。若有11.2 L 氯气(标准状况)参与反应,则必有____mol_____离子(填离子符号)由交换膜______侧通过交换膜向________迁移。交换膜右侧溶液中c(HCl)_____(填“>”“<”或“=”)1 mol·L-1(忽略溶液体积变化)。
答案: (1)2a >(2)1 Cl- 右 左 =
解析:
(1)正极的电极反应式为Cl2+2e-===2Cl-,负极的电极反应式为Ag-e-+Cl-===AgCl,隔膜只允许氢离子通过,转移a mol电子,必有a mol Cl-沉淀。为了维持电荷平衡,交换膜左侧溶液中必有amol H+向交换膜右侧迁移,故交换膜左侧共减少2amol离子(amol Cl-+amol H+)。交换膜右侧溶液中氯化氢浓度增大。
(2)n(Cl2)=0.5 mol,n(Cl-)=1 mol。正极的电极反应式为Cl2+2e-===2Cl-,n(e-)=1 mol,Ag-e-+Cl-===AgCl,交换膜右侧溶液中增加了1 mol 负电荷(或增加了1 mol Cl-),左侧减少了1 mol 负电荷(或减少了1 mol Cl-)。如果质子交换膜换成阴离子交换膜,只允许阴离子(Cl-)通过交换膜,不允许H+通过。为了维持电荷平衡,必有1 mol Cl-从交换膜右侧溶液中通过交换膜向左侧迁移,氯离子迁移之后,两侧溶液中盐酸浓度保持不变。
三、提高产品纯度
解这类问题可以分三步:
第一步,分清隔膜类型。即交换膜属于阳膜、阴膜或质子膜中的哪一种,判断允许哪种离子通过隔膜。
第二步,写出电极反应式,判断交换膜两侧离子变化,推断电荷变化,根据电荷平衡判断离子迁移方向。
第三步,分析隔膜作用。在产品制备中,隔膜作用主要是提高产品纯度,避免产物之间发生反应,或避免产物因发生反应而造成危险。
典例3 H3PO2也可用电渗析法制备,“四室电渗析法”工作原理如图所示(阳膜和阴膜分别只允许阳离子、阴离子通过):
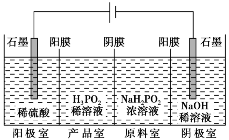
(1)写出阳极的电极反应式_________________。
(2)分析产品室可得到H3PO2的原因________________。
(3)早期采用“三室电渗析法”制备H3PO2:将“四室电渗析法”中阳极室的稀硫酸用H3PO2稀溶液代替。并撤去阳极室与产品室之间的阳膜,从而合并了阳极室与产品室。其缺点是产品中混有________杂质,该杂质产生的原因是_____________________________。
答案: (1)2H2O-4e-===O2↑+4H+
(2)阳极室的H+穿过阳膜扩散至产品室,原料室的H2PO2-穿过阴膜扩散至产品室,二者反应生成H3PO2
(3)PO43-、H2PO2-或H3PO2被氧化
解析:(2)中应该从闭合回路的角度,阴、阳离子的流向分析;(3)注意阳极反应生成O2,O2具有氧化性,H3PO2和H2PO2-均具有还原性,二者会被O2氧化生成PO43-。
走近高考
1.(2021·全国甲卷,13)乙醛酸是一种重要的化工中间体,可用如下图所示的电化学装置合成。图中的双极膜中间层中的H2O解离为H+和OH-,并在直流电场作用下分别向两极迁移。下列说法正确的是( )
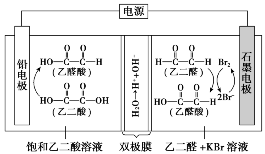
A.KBr在上述电化学合成过程中只起电解质的作用
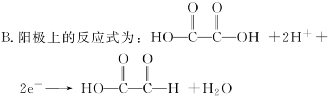
C.制得2 mol 乙醛酸,理论上外电路中迁移了1 mol 电子
D.双极膜中间层中的H+在外电场作用下向铅电极方向迁移
答案:D
解析:
A.KBr在上述电化学合成过程中除作电解质外,同时还是电解过程中阳极的反应物,生成的Br2为乙二醛制备乙醛酸的中间产物,故A错误;
B.阳极上为Br-失去电子生成Br2,Br2将乙二醛氧化为乙醛酸,故B错误;
C.电解过程中阴阳极均生成乙醛酸,1 mol 乙二酸生成1 mol 乙醛酸转移电子为2 mol,1 mol 乙二醛生成1 mol 乙醛酸转移电子为2 mol,根据转移电子守恒可知每生成1 mol 乙醛酸转移电子为1 mol,因此制得2 mol 乙醛酸时,理论上外电路中迁移了2 mol 电子,故C错误;
D.由上述分析可知,双极膜中间层的H+在外电场作用下移向阴极,即H+移向铅电极,故D正确。
2.(2020·山东等级考,13)采用惰性电极,以去离子水和氧气为原料通过电解法制备双氧水的装置如下图所示。忽略温度变化的影响,下列说法错误的是( )
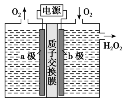
A.阳极反应2H2O-4e-===4H++O2↑
B.电解一段时间后,阳极室的pH未变
C.电解过程中,H+由a极区向b极区迁移
D.电解一段时间后,a极生成的O2与b极反应的O2等量
答案:D
解析:
A.依据分析a极是阳极,属于放氧生酸型的电解,所以阳极的反应式是2H2O-4e-===4H++O2↑,故A正确,但不符合题意;
B.电解时阳极产生氢离子,氢离子是阳离子,通过质子交换膜移向阴极,所以电解一段时间后,阳极室的pH值不变,故B正确,但不符合题意;
C.由B的分析可知,C正确,但不符合题意;
D.电解时,阳极的反应为:2H2O-4e-===4H++O2↑,阴极的反应为:2O2+4e-+4H+===2H2O2,总反应为:O2+2H2O===2H2O2,要消耗氧气,即是a极生成的氧气小于b极消耗的氧气,故D错误。

- 全部评论(0)
