专题突破:带膜的电化学装置
时间:2021-12-08 08:33 来源:未知 作者:化学自习室 点击: 次 所属专题: 离子交换膜
版权申明:凡是署名为“化学自习室”,意味着未能联系到原作者,请原作者看到后与我联系(邮箱:79248376@qq.com)!
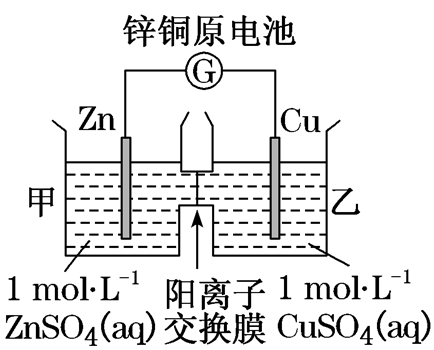
近几年全国卷的高考中,涉及离子交换膜的试题较多,且常考常新。离子交换膜是一种含有离子基团的、对溶液中离子具有选择性透过的高分子膜。根据透过的微粒类型,离子交换膜可以分为多种,在高考试题中,主要出现的是阳离子交换膜(如2019·全国卷ⅠT12、2019·江苏卷T20、2018·全国卷ⅠT27、2018·全国卷ⅢT27)、阴离子交换膜(2014·全国卷ⅠT27)和质子交换膜(2018·全国卷ⅠT13、2015·全国卷ⅠT11)三种,其功能是在于选择性通过某些离子和阻断某些离子或隔离某些物质,从而制备、分离或提纯某些物质。
类型一:离子交换膜的种类
【考必备清单】
1.含义和作用
(1)含义:离子交换膜又叫隔膜,由高分子特殊材料制成。
2.作用:
①能将两极区隔离,阻止两极区产生 的物质接触,防止发生化学反应。
②能选择性的通过离子,起到平衡电 荷、形成闭合回路的作用。
3.分类和应用
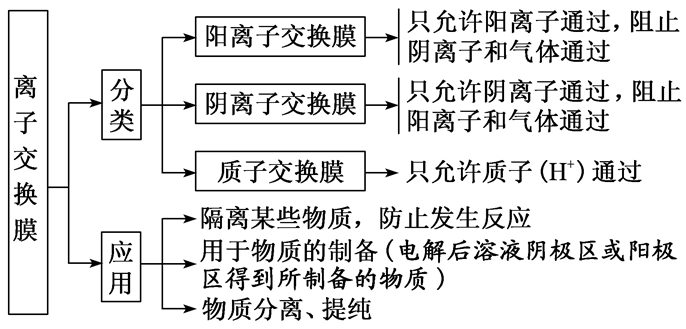
4.三类离子交换膜应用实例
种类 | 装置图 | 说明 |
阳离子交换膜 (只允许阳离子和水分子通过) |
| ①负极反应式: Zn-2e-===Zn2+ ②正极反应式:Cu2++2e-===Cu ③Zn2+通过阳离子交换膜进入正极区 ④阳离子→透过阳离子交换膜→原电池正极(或电解池的阴极) |
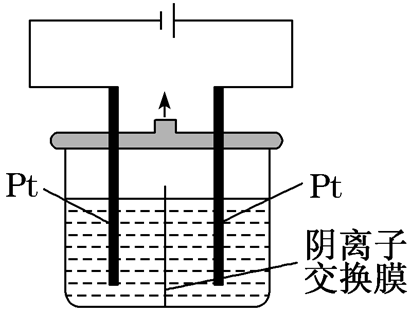
阴离子交换膜 (只允许阴离子和水分子通过) | 以Pt为电极电解淀粉-KI溶液, 中间用阴离子交换膜隔开
| ①阴极反应式:2H2O+2e-===H2↑+2OH- ②阳极反应式:2I--2e-===I2 ③阴极产生的OH-移向阳极与阳极产物反应: 3I2+6OH-===IO3-+5I-+3H2O ④阴离子→透过阴离子交换膜→电解池阳极(或原电池的负极) |
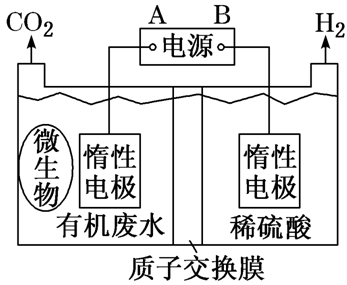
质子交换膜 (只允许H+和水分子通过) | 在微生物作用下电解有机废水(含CH3COOH), 可获得清洁能源H2
| ①阴极反应式:2H++2e-===H2↑ ②阳极反应式:CH3COOH-8e-+2H2O===2CO2↑+8H+ ③阳极产生的H+通过质子交换膜移向阴极 ④H+→透过质子交换膜→原电池正极(或电解池的阴极) |
探题源•规律
[例1] 四室式电渗析法制备盐酸和NaOH的装置如图所示。A、B、C为阴、阳离子交换膜。已知:阴离子交换膜只允许阴离子透过,阳离子交换膜只允许阳离子透过。下列叙述正确的是 ( )
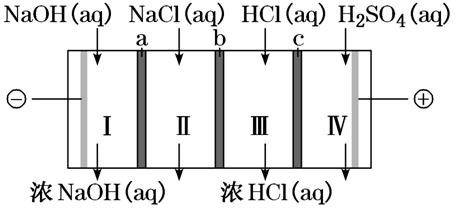
A.B、C分别依次为阳离子交换膜、阴离子交换膜
B.通电后Ⅲ室中的Cl-透过C迁移至阳极区
C.Ⅰ、Ⅱ、Ⅲ、Ⅳ四室中的溶液的pH均升高
D.电池总反应为4NaCl+6H2O 4NaOH+4HCl+2H2↑+O2↑
4NaOH+4HCl+2H2↑+O2↑
[解析] 由图中信息可知,左边电极与负极相连为阴极,右边电极为阳极,所以通电后,阴离子向右定向移动,阳离子向左定向移动,阳极上H2O放电生成O2和H+,阴极上H2O放电生成H2和OH-;H+透过C,Cl-透过b,二者在b、c之间的Ⅲ室形成盐酸,盐酸浓度变大,所以b、c分别为阴离子交换膜和阳离子交换膜;Na+透过a,NaOH的浓度变大,所以a也是阳离子交换膜,故A、B两项均错误;电解一段时间后,Ⅰ中的溶液的c(OH-)升高,pH升高,Ⅱ中为NaCl溶液,pH不变,Ⅲ中有HCl生成,故C(H+)增大,pH减小,Ⅳ中H+移向Ⅲ,H2O放电生成O2,使水的量减小,C(H+)增大,pH减小,C不正确。
[规律方法] 离子交换膜类型的判断方法
根据电解质溶液呈电中性的原则,判断膜的类型,判断时首先写出阴、阳两极上的电极反应,依据电极反应式确定该电极附近哪种离子剩余,因该电极附近溶液呈电中性,从而判断出离子移动的方向,进而确定离子交换膜的类型,如电解饱和食盐水时,阴极反应式为2H++2e-===H2↑,则阴极区域破坏水的电离平衡,OH-有剩余,阳极区域的Na+穿过离子交换膜进入阴极室,与OH-结合生成NaOH,故电解食盐水中的离子交换膜是阳离子交换膜。
类型二 离子交换膜在物质制备、分离提纯中的应用
考必备•清单
应用离子交换膜的常考装置——多室电解池
多室电解池是利用离子交换膜的选择透过性,即允许带某种电荷的离子通过而限制带相反电荷的离子通过,将电解池分为两室、三室、多室等,以达到物质制备、浓缩、净化、提纯的目的。
(1)两室电解池
①制备原理:工业上利用如图两室电解装置制备烧碱
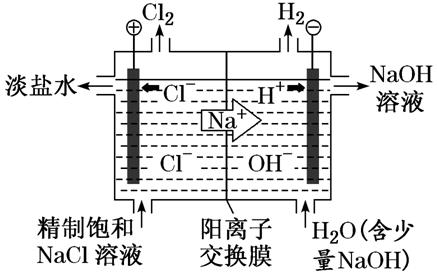
阳极室中电极反应:2Cl--2e-===Cl2↑,阴极室中的电极反应:2H2O+2e-===H2↑+2OH-,阴极区H+放电,破坏了水的电离平衡,使OH-浓度增大,阳极区Cl-放电,使溶液中的c(Cl-)减小,为保持电荷守恒,阳极室中的Na+通过阳离子交换膜与阴极室中生成的OH-结合,得到浓的NaOH溶液。利用这种方法制备物质,纯度较高,基本没有杂质。
②阳离子交换膜的作用它只允许Na+通过,而阻止阴离子(Cl-)和气体(Cl2)通过。这样既防止了两极产生的H2和Cl2混合爆炸,又避免了Cl2和阴极产生的NaOH反应生成NaClO而影响烧碱的质量。
(2)三室电解池
利用三室电解装置制备NH4NO3,其工作原理如图所示。
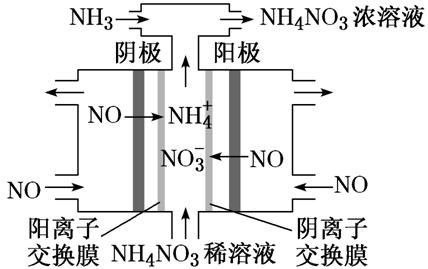
阴极的NO被还原为NH4+:NO+5e-+6H+===NH4++H2O,NH4+通过阳离子交换膜进入中间室;阳极的NO被氧化为NO3-:NO-3e-+2H2O===NO3-+4H+,NO3-通过阴离子交换膜进入中间室。根据电路中转移电子数相等可得电解总反应:8NO+7H2O 3NH4NO3+2HNO3,为使电解产物全部转化为NH4NO3,补充适量NH3可以使电解产生的HNO3转化为NH4NO3。
3NH4NO3+2HNO3,为使电解产物全部转化为NH4NO3,补充适量NH3可以使电解产生的HNO3转化为NH4NO3。
(3)多室电解池
利用“四室电渗析法”制备H3PO2(次磷酸),其工作原理如图所示。
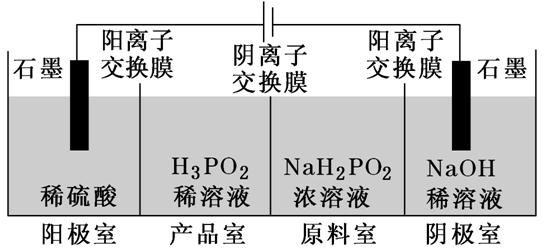
电解稀硫酸的阳极反应:2H2O-4e-===O2↑+4H+,产生的H+通过阳离子交换膜进入产品室,原料室中的H2PO2-穿过阴离子交换膜进入产品室,与H+结合生成弱电解质H3PO2;电解NaOH稀溶液的阴极反应:4H2O+4e-===2H2↑+4OH-,原料室中的Na+通过阳离子交换膜进入阴极室。
探题源•规律
应用一 物质的制备
[例2] 用惰性电极电解法制备硼酸[H3BO3或B(OH)3]的工作原理如图所示(阳膜和阴膜分别只允许阳离子和阴离子通过)。下列有关说法正确的是 ( )
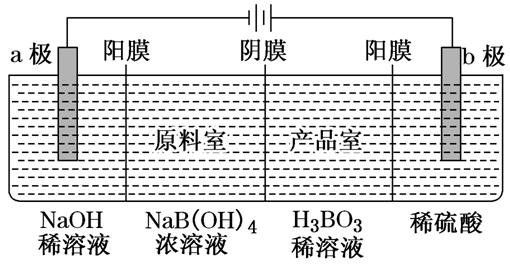
A.阴极与阳极产生的气体体积比为2∶1
B.b极的电极反应式为2H2O-2e-===O2↑+4H+
C.产品室中发生的反应是B(OH)3+OH-===B(OH)4-
D.每增加1 mol H3BO3产品,NaOH溶液增重22 g
[解析] 由图可知,b电极为阳极,电解时阳极上水失电子发生氧化反应生成O2和H+,a电极为阴极,电解时阴极上水得电子发生还原反应生成H2和OH-,原料室中的钠离子通过阳膜进入a极室,溶液中c(NaOH)增大,原料室中B(OH)4-通过阴膜进入产品室,b极室中H+通过阳膜进入产品室,在产品室中H+与B(OH)4-发生反应生成H3BO3,a、b两电极反应式分别为2H2O+2e-===H2↑+2OH-,2H2O-4e-===O2↑+4H+,理论上每生成1 mol 产品,b极生成1 mol H+,a极产生0.5 mol H2。
[规律方法]
有“膜”条件下离子定向移动方向的判断方法

应用二 物质的分离和提纯
[例3] 用电解法可提纯含有某种钾的含氧酸盐杂质(如硫酸钾、碳酸钾等)的粗KOH溶液,其工作原理如图所示。下列说法正确的是 ( )
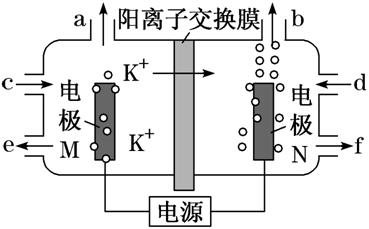
A.电极N为阳极,电极M上H+发生还原反应
B.电极M的电极反应式为4OH--4e-===2H2O+O2↑
C.D处流进粗KOH溶液,E处流出纯KOH溶液
D.b处每产生11.2 L 气体,必有1 mol K+穿过阳离子交换膜
[解析] 根据图示,K+移向电极N,所以N是阴极,M极是阳极,OH-发生氧化反应生成氧气,电极反应式为4OH--4e-===2H2O+O2↑,故A错误,B正确;C处流进粗KOH溶液,F处流出纯KOH溶液,故C错误;N极是阴极,H+发生还原反应生成氢气,非标准状况下11.2 L 氢气的物质的量不一定是0.5 mol,故D错误。
[规律方法] 含离子交换膜电化学装置题的解题步骤

夯基础•小题
3.一种三室微生物燃料电池可用于污水净化、海水淡化,其工作原理如图所示,图中有机废水中有机物可用C6H10O5表示。下列有关说法不正确的是 ( )
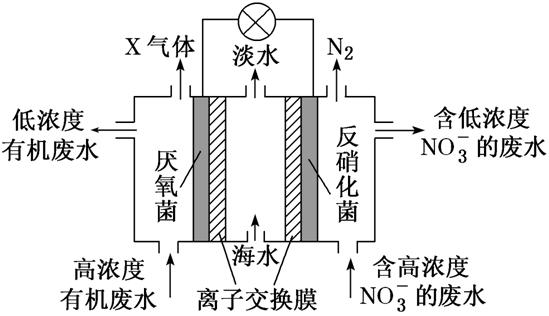
A.Cl-由中间室移向左室
B.X气体为CO2
C.处理后的含NO废水的pH降低
D.电路中每通过4 mol 电子,产生X气体的体积为22.4 L
解析:该电池中,NO3-得电子发生还原反应,则装置中右边电极是正极,电极反应式为2NO3-+10e-+12H+===N2↑+6H2O,装置左边电极是负极,负极上有机物失电子发生氧化反应生成X,电极反应式为C6H10O5-24e-+7H2O===6CO2↑+24H+。放电时,电解质溶液中阴离子Cl-移向负极室(左室),A项正确;X气体为CO2,B项正确;正极反应为2NO3-+10e-+12H+===N2↑+6H2O,H+参加反应导致溶液酸性减弱,溶液的pH增大,C项错误;因题目未指明标准状况,故无法计算产生CO2(X)气体的体积,D项错误。
答案:CD

- 全部评论(0)