实验评价有几何?
时间:2023-01-02 10:45 来源:未知 作者:化学自习室 点击: 次 所属专题: 实验评价
版权申明:凡是署名为“化学自习室”,意味着未能联系到原作者,请原作者看到后与我联系(邮箱:79248376@qq.com)!
化学实验方案的设计是指在实施化学实验之前,根据化学实验的目的和要求,运用相关的化学知识和实验技能,对实验的仪器、装置和方法所进行的一种规划。需要从科学性、安全性、可行性、简约性、经济性几个角度进行考虑。
化学实验方案的评价则是通过对设计的实验方案进行分析,对实验方案的优劣进行评价。主要从实验原理是否科学合理、操作与装置是否简单可行、实验方案是否符合绿色化学要求、实验操作是否安全等方面进行评价。
一、实验方案的设计
1.物质制备实验方案设计
(1)列出可能的几种制备方法和途径,从方法是否可行,装置和操作是否简单、是否经济与安全等方面进行分析和比较,从中选取最佳的实验方法。
(2)制备实验应注意防污染、防倒吸、防氧化、防潮解、防爆炸。
(3)要求产品易分离、易收集;杂质少、步骤少。
(4)反应物:要尽可能价廉易得、无毒无腐蚀性;反应条件:要易于控制;装置简单。
2、物质性质验证实验方案的设计
(1)根据物质的结构、用途预测可能的性质
(2)利用物质的性质设计验证性实验方案。
3.物质检验实验方案的设计
(1)先对试样进行外观观察其颜色、状态、气味等。
(2)若样品是固体,一般先取少量配成溶液;并注意观察试样的溶解情况:是否溶解、有无气体产生、有无明显的热效应、所得水溶液的颜色等
(3)进行检验:每次均应移取少量溶液进行检验
(4)一般通过离子的检验来实现
二、实验方案设计的评价方法
1.实验方案是否科学可行,实验方案是否遵循化学原理。
2.在实际操作时能否做到可控易行。
3.实验方案要符合”绿色化学”要求。
4.反应原料是否易得、安全、无毒;反应速率是否较快;原料利用率及合成物质的产率是否较高;合成过程是否造成环境污染。
5.从”安全性”方面对实验方案做出评价。
典例1、从实验原理可行性评价
实验室制备Al2S3,下列方案可行的是( )
A.将AlCl3溶液与Na2S溶液混合
B.将H2S气体通入Al2(SO4)3溶液中
C.将Al(NO3)3固体与K2S固体混合
D.将金属铝与硫黄混合加热
解析:该题首先从原理角度辨析了Al2S3的制备,要注意可溶性的铝盐和硫化物溶液相遇会发生相互促进的水解反应,水解的离子方程式为2Al3++3S2-+6H2O===2Al(OH)3↓+3H2S↑,同理将H2S气体通入Al2(SO4)3溶液也无法制备Al2S3,只有将金属铝与硫黄混合加热,方可制得。
答案:D
典例2、从原料的用量多少评价
以Al、稀H2SO4和NaOH为原料制取Al(OH)3,甲、乙、丙3个学生分别用3种不同的途径制备:
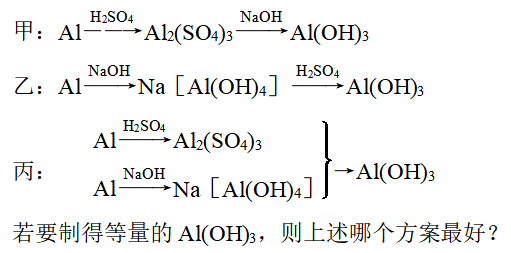
解析:现将甲、乙、丙三个方案制取1 mol Al(OH)3消耗的硫酸和氢氧化钠的物质的量剖析如下:
| 实验方案(简述过程) | 消耗H2SO4/mol | 消耗NaOH/mol | ||
甲:Al→Al2(SO4)3→Al(OH)3 | 1.5 | 3 | ||
乙:Al→Na[Al(OH)4]→Al(OH)3 | 0.5 | 1 | ||
丙 | Al→Al2(SO4)3 | →Al(OH)3 | 3/8 | 3/4 |
Al→Na[Al(OH)4] | ||||
丙方案最好,产生等量Al(OH)3时所用原料最省。
答案: 丙
典例3、从是否符合“绿色化学”观念评价
下表是制取硝酸铜的三种方案,能体现绿色化学理念的最佳方案是____________,理由是________________________________。
方案 | 反应物 |
甲 | Cu和浓HNO3 |
乙 | Cu和稀HNO3 |
丙 | Cu、O2和稀HNO3 |
解析: 甲方案中Cu与浓HNO3反应生成污染环境的气体NO2,乙方案中铜与稀HNO3反应生成有毒气体NO,这两种方案中硝酸的利用率低。丙方案中Cu与O2反应生成CuO,然后用CuO与稀HNO3反应生成Cu(NO3)2,不产生污染环境的气体,且硝酸利用率高,故丙方案体现绿色化学理念。
答案: 丙 甲、乙两方案都产生有毒的氮氧化物,丙方案硝酸利用率高
典例4、从不同装置的优化组合进行评价
某化学课外小组研究乙醇氧化的实验并验证其产物,设计了甲、乙、丙三套装置(图中的支撑仪器均未画出,“Δ”表示酒精灯热源),每套装置又划分为①②③三部分。仪器中盛放的试剂:A.无水乙醇(沸点:78℃);B.铜丝;C.无水硫酸铜;D.新制氢氧化铜悬浊液。
(1)简述三套方案各自的优点。

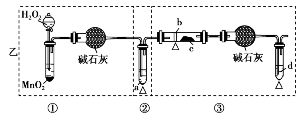
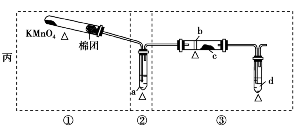
甲:________________________________;
乙:_______________________________;
丙:________________________________。
(2)集中三套方案的优点,组成一套比较合理完善的实验装置,可按气流由左到右的顺序表示为 (例如:甲①,乙②,丙③)。
解析:(1)甲的优点在于②,水浴加热能较好地控制温度,使气流平稳、反应充分。乙的优点在于两干燥管考虑了溶液中水汽对产物H2O检验的干扰,丙的优点在①,无水生成,且装置简单。(2)将三套方案的优点组合:取丙①、甲②、乙③可组成一套完善的装置。
答案:
(1)
甲:②中用热水浴加热,可形成较平稳的乙醇气流,使反应更充分;②中的斜长导管起到冷凝回流乙醇的作用
乙:①与③中的干燥管可防止溶液中的水与无水硫酸铜反应,避免干扰对生成物的验证
丙:①中氧气发生装置中无水生成,且装置简单
(2)丙①,甲②,乙③
典例5、从实验方案的优劣对比进行评价
某纯碱样品中含有氯化钠,测定纯碱样品纯度的方案有:
方案1:称样品质量,加入足量稀硫酸,用碱石灰吸收二氧化碳,称重;
方案2:称样品质量,溶于水,加入过量氯化钙溶液,过滤烘干后称量沉淀质量;
方案3:称样品质量,加入过量盐酸,充分反应,蒸干,称固体质量;
方案4:称样品质量,加入硫酸,排水法收集并测定二氧化碳体积;
你认为最优方案是 。
解析:
方案1:碱石灰吸收的除CO2的质量外,还有稀H2SO4挥发出的水蒸气,故测得Na2CO3的纯度偏高;
方案2:碳酸钙烘干时易分解,且碳酸钙表面吸附杂质,称量的质量不准确。
方案3:氯化钠稳定,将NaCl溶液蒸干后即得NaCl固体质量,可通过前后质量差测定Na2CO3的纯度。
方案4:CO2能溶于水,且能与水发生反应,故测定CO2的体积不准确。
答案:方案3
实战演练
某化学课外活动小组通过实验研究NO2的性质,已知:2NO2+2NaOH=NaNO3+NaNO2+H2O。
任务1:利用如图所示装置探究NO2能否被NH3还原(K1、K2为止水夹,夹持固定装置略去)。
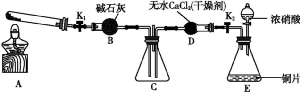
(1)E装置中制取NO2反应的化学方程式是 。
(2)若NO2能够被NH3还原,预期观察到C装置中的现象是 。
(3)实验过程中,未能观察到C装置中的预期现象。该小组同学从反应原理的角度分析了原因,认为可能是:
①NH3还原性较弱,不能将NO2还原;
②在此条件下,NO2的转化率极低;
③ 。
(4)此实验装置存在一个明显的缺陷是 。
任务2:探究NO2能否与Na2O2发生氧化还原反应。
(5)实验前,该小组同学提出三种假设。
假设1:二者不反应;
假设2:NO2能被Na2O2氧化;
假设3: 。
(6)为了验证假设2,该小组同学选用任务1中的B、D、E装置,将b中的药品更换为Na2O2,另选F装置(如图所示),重新组装,进行实验。
①装置的合理连接顺序是 。
②实验过程中,B装置中淡黄色粉末逐渐变成白色。经检验,该白色物质为纯净物,且无其他物质生成。推测B装置中反应的化学方程式为 。
答案:(1)Cu+4HNO3(浓) Cu(NO3)2+2NO2↑+2H2O
Cu(NO3)2+2NO2↑+2H2O
(2)C装置中混合气体颜色变浅
(3)在此条件下,该反应的化学反应速率极慢
(4)缺少尾气吸收装置
(5)NO2能被Na2O2还原
(6)①EDBF ②2NO2+Na2O2==2NaNO3
解析:(1)浓硝酸在加热条件下与铜片反应制取NO2:Cu+4HNO3(浓)==Cu(NO3)2+2NO2↑+2H2O。
(2)由于NO2气体是红棕色的,若NO2能够被NH3还原,随NO2的消耗,气体颜色会变浅。
(3)①从反应能否发生角度作出假设;②从化学平衡角度作了假设;③可以从反应速率作出假设,也可能是二者反应速率极慢,短时间内无法观察到气体颜色的变化。
(4)NO2与NH3都是有毒气体,即使二者能够发生反应,也会反应不完全,剩余气体逸散到空气中造成污染。应该增加尾气处理装置。
(5)由于Na2O2中的氧元素处于-1价,既有氧化性,也有还原性,所以NO2也可能被Na2O2还原。
(6)①整个实验的设计原理为:利用E制取NO2气体,通过D装置进行干燥,然后进入b装置进行验证实验,最后通过F装置吸收未反应的NO2气体,所以装置的连接顺序是EDBF。
②白色物质为纯净物,且无其他物质生成,只可能是NO2被氧化为了N2O5,与生成的Na2O化合为NaNO3。

- 全部评论(0)
