最全测量相关实验总结
时间:2023-08-13 10:28 来源:未知 作者:化学自习室 点击: 次 所属专题: 定量实验
版权申明:凡是署名为“化学自习室”,意味着未能联系到原作者,请原作者看到后与我联系(邮箱:79248376@qq.com)!
一、测量的仪器
1.【量筒】
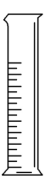
(1)主要用途:量取液体的体积(精度0.1 mL)
(2)使用方法和注意事项:
①不可加热;
②不可用于配液或作反应容器;
③应根据量取液体的体积选用合适的规格,规则为“大而近”;
④无0刻度线
2.【容量瓶】
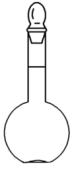
(1)主要用途:用于精确配制一定物质的量浓度的溶液
(2)使用方法和注意事项:
①根据要求选用一定规格的容量瓶,必须标明容量瓶规格
②溶液转入时要用玻璃棒引流;
③选择容量瓶时遵循“大而近”的原则,所需溶质的量按所选用的容量瓶的规格进行计算。如配制480 mL 1 mol/L NaOH溶液时应选用500 mL 的容量瓶,所需溶质NaOH的物质的量为0.5 mol;
④加水至距刻度线1~2 cm时,改用胶头滴管逐滴加水,使溶液凹面最低点恰好与刻度线水平相切;
⑤不能贮存配好的溶液,应将配好的溶液装入试剂瓶中;
⑥不能配制冷或热的溶液
⑦读数时,要平视滴定管中凹液面的最低点读取溶液的体积。
(3)容量瓶的验漏:
向容量瓶中加入自来水,塞好瓶塞,左手食指摁住塞子,右手五指托住瓶底,倒转容量瓶,观察瓶塞周围是否有水渗出。直立后,转动瓶塞180°,重复一次,若没有水渗出说明不漏水,不漏水的容量瓶才能使用。
3.【酸式滴定管(左)碱式滴定管(右)】
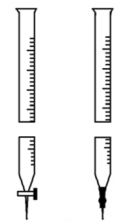
(1)主要用途:
①滴定操作的精确量器;
②精确量取液体体积(精度0.01 mL)
(2)使用方法和注意事项:
①使用前,首先检查滴定管是否漏液;
②酸式滴定管用来盛装酸性溶液,不能盛装碱性溶液;
③碱式滴定管用来盛装碱性溶液,不能盛装酸性溶液和氧化性溶液
④读数时,要平视滴定管中凹液面的最低点读取溶液的体积。
(3)酸式滴定管的验漏:
关闭活塞,向滴定管中加入适量水,用滴定管夹将滴定管固定在铁架台上,观察是否漏水,若2分钟内不漏水,将活塞旋转180°,重复上述操作。
(4)碱式滴定管的验漏:
向滴定管中加入适量水,用滴定管夹将滴定管固定在铁架台上,观察是否漏水,若2分钟内不漏水,轻轻挤压玻璃球,放出少量液体,再次观察滴定管是否漏水。
(5)酸式滴定管的气泡排除:
右手将滴定管倾斜30°左右,左手迅速打开活塞使溶液冲出,从而使溶液充满尖嘴。
(6)碱式滴定管的气泡排除:
将胶管弯曲使玻璃尖嘴向上倾斜,用两指捏住胶管,轻轻挤压玻璃珠,使溶液从尖嘴流出,即可赶出碱式滴定管中的气泡。
4.【温度计】

(1)主要用途:
①分馏时测量馏分的沸点;
②测量反应液温度;
③测量水浴温度
(2)使用方法和注意事项:
①不可用于搅拌;
②根据用途将水银球插在不同部位:
L蒸馏——蒸馏烧瓶支管口处
L测反应液温度——反应液面以下,但不能接触瓶底
L测水浴温度——水浴加热容器中的水面以下但不能接触瓶底
5.【托盘天平】
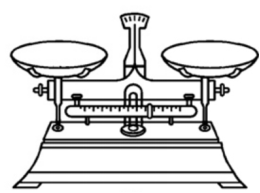
(1)主要用途:
称量药品(及仪器)的质量(精度0.1g)
(2)使用方法和注意事项:
①用前调零:要放置在水平的地方,游码要指向红色0刻度线,调节平衡螺母(天平两端的螺母)调节零点直至指针对准中央刻度线直至天平横梁水平位置平衡。
②药品不能直接放在托盘上;
③左物右码,先大后小;
④读数至小数点后1位。
6.【量气管】
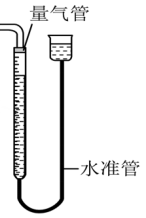
(1)主要用途:量取气体体积
(2)使用方法和注意事项:
①调节两管液面相平,并保证液面在“0”刻度或零刻度以上;
②所测气体不能与量气管中的溶液反应,且不互溶;
③要上下移动量气管使左右液体相平后读数;
④一定要等待气体冷却至室温时进行读数。
(3)量气管的验漏:
方法一:向玻璃管中假加入适量水,若能形成稳定的液面差,这证明装置气密性良好。
方法二:向上(下)移动量气管,若能形成稳定的液面差,这证明装置气密性良好。
7.【移液管】
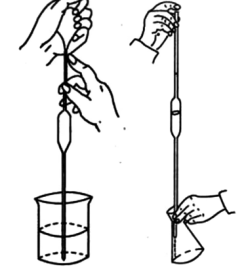
(1)主要用途:
准确移取一定体积量的溶液,常用移液管有5、10、25、50mL 的规格,精度(0.01mL)
(2)使用方法和注意事项:
①移液管(吸量管)不能移取太热或太冷的溶液。
②同一实验中应尽可能使用同一支移液管。
③移液管在使用完毕后,应立即用自来水及蒸馏水冲洗干净,置于移液管架上。
④移液管和容量瓶常配合使用,因此在使用前常作两者的相对体积校准。
⑤在使用吸量管时,为了减少测量误差,每次都应从最上面刻度(0刻度)处为起始点,往下放出所需体积的溶液,而不是需要多少体积就吸取多少体积。
二、相关测量实验
1.【酸碱中和滴定】
(1)测量仪器
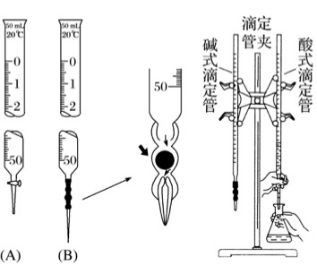
(A)酸式滴定管 (B)碱式滴定管
(2)误差分析
① 原理
cB=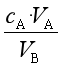 ,
,
VB是准确量取的待测液的体积,cA是标准溶液的浓度,它们均为定值,所以cB的大小取决于VA的大小,VA大则cB大,VA小则cB小。
② 因测量仪器引起的误差分析[以标准酸溶液滴定未知浓度的碱溶液(酚酞作指示剂)为例]:
步骤 | 操作 | VA | cB |
洗涤 | 酸式滴定管未用标准溶液润洗 | 变大 | 偏高 |
碱式滴定管未用待测溶液润洗 | 变小 | 偏低 | |
取液 | 量取碱液的滴定管开始有气泡,放出液体后气泡消失 | 变小 | 偏低 |
滴定 | 酸式滴定管滴定前有气泡,滴定终点时气泡消失 | 变大 | 偏高 |
酸式滴定管中部分酸液滴出锥形瓶外 | 变大 | 偏高 | |
读数 | 滴定前读数正确,滴定后俯视读数(或“前仰后俯” | 变小 | 偏低 |
滴定前读数正确,滴定后仰视读数(或“前俯后仰”) | 变大 | 偏高 |
2.【配置一定物质的量浓度的溶液】
(1)测量仪器:托盘天平、xxmL容量瓶、量筒
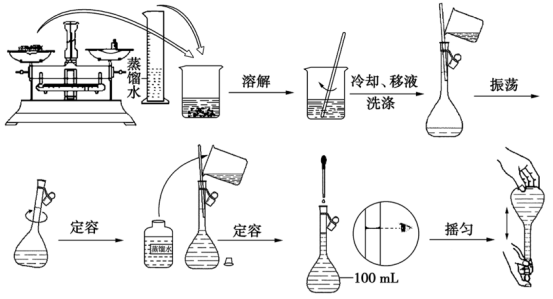
(2)因测量仪器引起的误差分析
| 可能引起误差的操作 | n | V | c |
天平砝码附着有其他物质或已生锈 | 增大 | 不变 | 偏大 |
用量筒量取需稀释的溶液时仰视读数 | 增大 | 不变 | |
定容时俯视容量瓶刻度线 | 不变 | 减小 | |
溶液未冷却就转入容量瓶进行定容 | 不变 | 减小 | |
砝码残缺 | 减小 | 不变 | 偏小 |
药品和砝码位置颠倒(使用游码) | 减小 | 不变 | |
定容时仰视容量瓶刻度线 | 不变 | 增大 | |
定容摇匀后又加蒸馏水 | 不变 | 增大 | |
用量筒量取需稀释的溶液时俯视读数 | 减小 | 不变 | |
定容时蒸馏水加多后用吸管吸出 | 减小 | 不变 | |
转移时有少量液体洒在容量 | 减小 | 不变 |
3.【中和反应反应热的测定】
(1)测量仪器:温度计

(2)温度计使用注意事项:要使用同一支温度计,温度计的水银球要完全浸入溶液中,读出变化过程中的最高温度。
(3)实验测量数据
①反应物温度的测量
a.用量筒量取50 mL 0.50 mol·L-1盐酸,打开杯盖,倒入量热计的内筒,盖上杯盖,插入温度计,测量并记录盐酸的温度(数据填入下表)。用水把温度计上的酸冲洗干净,擦干备用
b.用另一个量筒量取50 mL 0.55 mol·L-1NaOH溶液,用温度计测量并记录NaOH溶液的温度
②反应后体系温度测量
打开杯盖,将量筒中的NaOH溶液迅速倒入量热计的内筒,立即盖上杯盖,插入温度计,用搅拌器匀速搅拌。密切关注温度不变化,将最高温度记为反应后体系的温度(T2)
③重复上述步骤(1)至步骤(2)两次
(4)数据处理
中和热ΔH计算:
![]()
[C=4.18 J·(g·℃)-1]
三.定量测定型实验
1.【定量实验数据的测定方法】
(1)沉淀法:先将某种成分转化为沉淀,然后称量纯净、干燥的沉淀质量,再进行计算。
(2)测气体体积法:对于产生气体的反应,可以通过测定气体体积的方法测定样品纯度。
①常见测量气体体积的实验装置
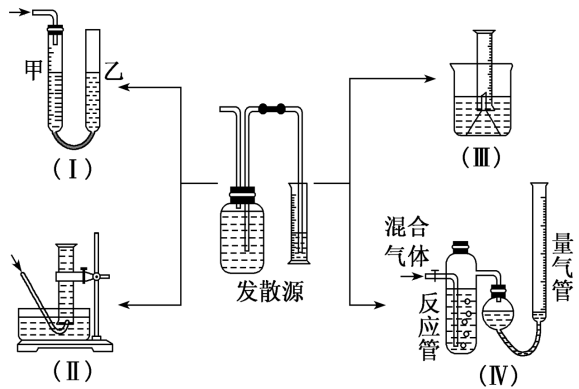
②量气时应注意的问题
A.量气时应保持装置处于室温状态。
B.读数时要特别注意消除“压强差”,保持液面相平,还要注意视线与液面最低处相平。如图(Ⅰ)(Ⅳ)应使左侧和右侧的液面高度保持相平。
(3)测气体质量法:将生成的气体通入足量的吸收剂中,通过称量实验前后吸收剂的质量,求得所吸收气体的质量,然后进行相关计算。
(4)滴定法:即利用滴定操作原理,通过酸碱中和滴定、沉淀滴定或氧化还原滴定等获得相应数据后,再进行相关计算
2.【注意事项】
(1)测定实验中要有消除干扰气体的意识:如用“惰性”气体将干扰气体排出,或用溶液吸收干扰气体等。
(2)测定实验中要有被测量气体全部被测量的意识:如在反应结束后继续向装置中通入“惰性”气体,以使被测量气体全部排出使之被吸收剂吸收。
(3)测定实验中要有“数据”的采集处理意识
①实验数据的采集是化学计算的基础,一般来讲,固体试剂称质量,而液体试剂和气体试剂测量体积。
②称量固体质量时,中学一般用托盘天平,可估读到0.1 g,精确度要求高的实验中可以用分析天平或电子天平,可精确到0.000 1 g;
③测量液体体积时,一般实验中选用适当规格的量筒,可估读到0.1 mL,准确度要求高的定量实验,如中和滴定中选用滴定管(酸式或碱式),可估读到0.01 mL。容量瓶作为精密的定容仪器,用于配制一定物质的量浓度的溶液,一般不用于量取液体的体积;
④气体除了量取外,还可以称量。称气体的质量时一般有两种方法:一种方法是称反应装置在放出气体前后的质量减小值;另一种方法是称吸收装置前后的质量增大值;
⑤用pH试纸(测得整数值)或pH计(精确到0.01)直接测出溶液的pH,经过计算可以得到溶液中H⁺或OH⁻的物质的量浓度。为了数据的准确性,实验中要采取必要的措施,确保离子完全沉淀、气体完全被吸收等,必要时可以进行平行实验,重复测定,然后取其平均值进行计算。

- 全部评论(0)
 )
) 瓶外
瓶外