概念辨析:基态与激发态及构造原理与电子排布式
时间:2023-01-02 15:47 来源:未知 作者:化学自习室 点击:次 所属专题: 电子排布式 构造原理
版权申明:凡是署名为“化学自习室”,意味着未能联系到原作者,请原作者看到后与我联系(邮箱:79248376@qq.com)!
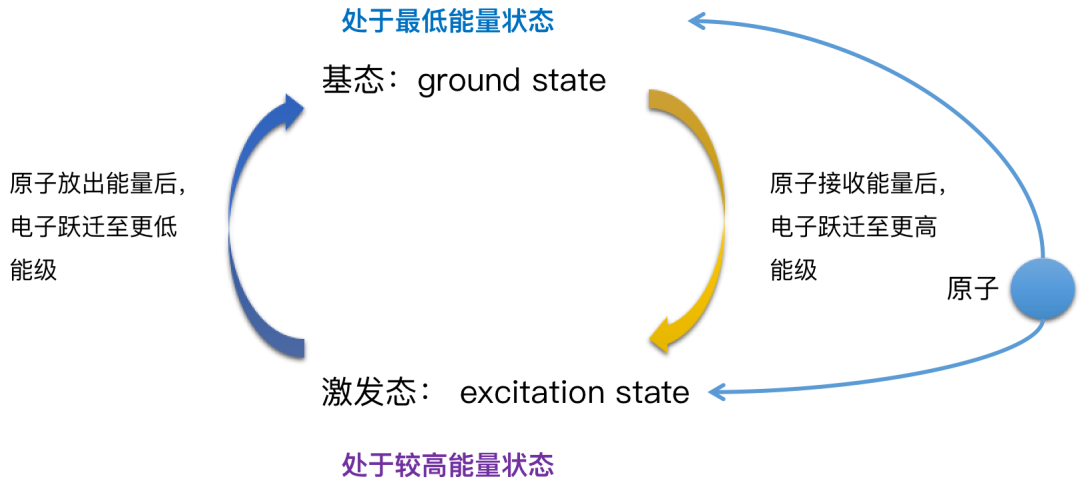
基态和激发态
什么是光谱?
光谱:不同元素的原子发生跃迁时会吸收(基态→激发态)或释放(激发态→基态)不同的光,可以用光谱仪摄取各种元素的电子的吸收光谱或发射光谱,总称原子光谱。
光谱分析:在现代化学中,常利用原子光谱上的特征谱线来鉴定元素,称为光谱分析。
什么是构造原理?
构造原理指的是:设想从氢原子开始,随着原子核电荷数的递增,原子核每增加一个质子,原子核外便增加一个电子,电子填满一个能级再填一个能级,这种规律叫做构造原理。
以上比较科学的表述,但是如果用大白话来理解就是:电子一个个进入核外轨道的入场顺序。
这是个啥顺序呢?打个比方,初升高的分班 ······ 逛麻线的样子。
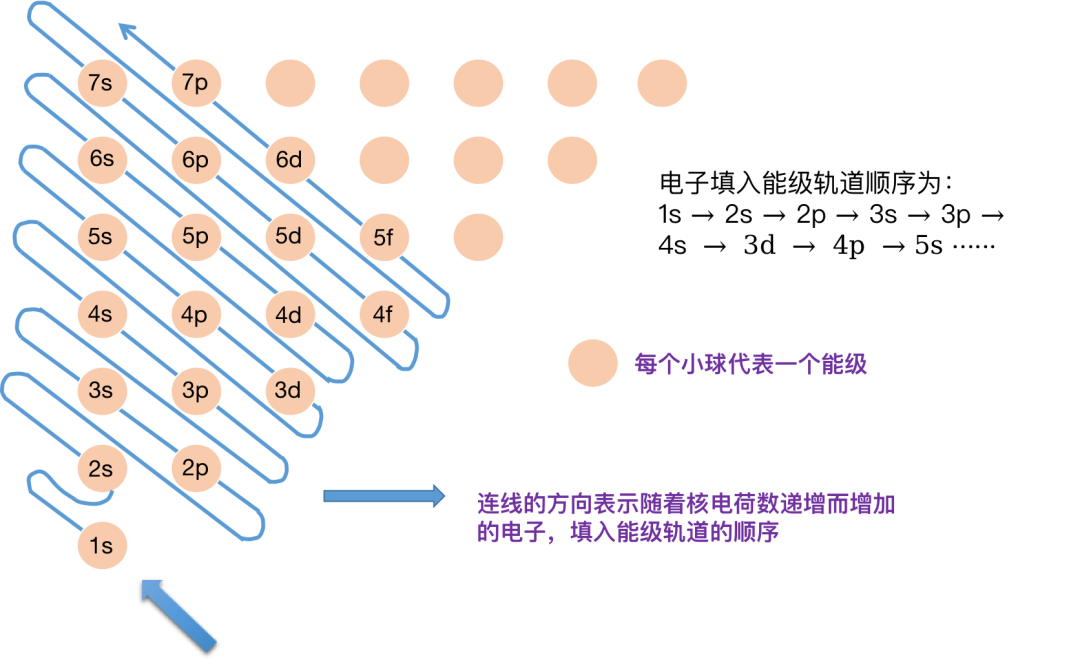
构造原理中的能级交错:
构造原理中会出现 “ 能级交错 ” 现象,指的是序数较大的能层中某些能级的能量反而低于能级序数较小的能层中的能级能量的现象。
这个有点绕口,我们看个例子,看上图:
比如 3d 属于 第 3 能层的 d 能级 ,4s 属于 第 4 能层的 s 能级,但是 3d 轨道的能级要高于 4s 轨道能级,所以如果添加电子,电子会先跑到 4s 轨道上,等 4s 轨道上的 2 个电子填满后,才能进入能量门槛更高的 3d 轨道。
电子按照构造原理排布,会使整个原子的能量处于最低状态,原子会较为稳定。
电子排布式是用数字在能级符号右上角标明该能级上排布的电子数的式子。
例如,一个 Mg 原子完整的电子排布式如下:
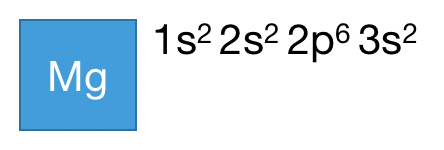
就是按照构造原理,把 原子序数为 12 的 Mg 中的 12 个电子,挨个填空。12个空填完结束。
但是, but ,有的原子序数比较大,比如原子序数大几十的那种原子,它的电子排布式写起来岂不是要一长串?不仅非常麻烦,还容易错,那怎么办?
找捷径!!!
通常把内层电子达到稀有气体结构的部分,以相应的稀有气体符号外加方括号来表示。
说人话就是,找个最接近的比自己的小的稀有气体,在稀有气体的结构增加点电子变成自己的电子排布式。
比如 Na 原子,一共有 11 个电子,距离 Na 最近的稀有气体原子是 Ne ,Na 和 Ne 的电子排布式:
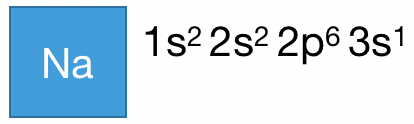
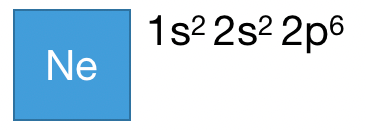
所以 Na 的电子排布式可以简化为:
![]()
关于电子排布,还有一个价电子层的概念:
化学反应中可能发生电子变动的能级称为价电子层(简称价层)
比如,刚才的 Na , Na 的价层为 :
![]()
最后,大家可以尝试写一下 Cu 的电子排布式与价层。
PS : Cu 的原子序数为 29 ,第四周期 、第 I B 族。

- 全部评论(0)
